题目内容
A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素,且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多1,B、C、F的质子数之和等于E、G的质子数之和.请回答下列问题:
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式 (至少写出两种).
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为 (用化学式表示).
(3)A、C、G能形成一种3原子分子,试写出它的电子式 ,C与D能形成一种相对分子质量为78的化合物,它的电子式为 ;②中所含的化学键有: .
(4)D、E两种元素的原子都能形成相应的简单离子,则两离子半径大小关系为 (用离子符号表示);将D、E两种元素的单质同时投入水中,充分反应后,测得溶液中只有一种溶质,且无固体物质剩余,则所投入到水中的D的单质和E的单质的质量之比为 ,上述反应的化学方程式为 .
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
(2)A分别与B、C、G能形成相应的最常见三种化合物,这三种化合物的沸点由高到低的顺序为
(3)A、C、G能形成一种3原子分子,试写出它的电子式
(4)D、E两种元素的原子都能形成相应的简单离子,则两离子半径大小关系为
考点:位置结构性质的相互关系应用
专题:电化学专题
分析:元素A的原子核内仅有一个质子,则A为H元素;A、D同主族,且A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大,可知D为Na元素;
C与F同主族,F的质子数为C的2倍,则C为O元素,F为S元素;
元素E的最外层电子数比K层电子数多1,E应为Al元素;
B、C为同周期元素,应为第二周期元素,且与A能形成相同电子数的化合物,则B可能为C元素、也可能为N元素,根据B、C、F的质子数之和等于E、G的质子数之和,如B为C元素,则:6+8+16=13+G,G的原子序数为17,应为Cl元素,如B为N元素,则7+8+16=13+G,G的原子序数为18,为Ar元素,不属于主族元素,不符合题意,
根据元素所在周期表中的位置结合元素周期律推断元素、单质及其化合物的性质.
C与F同主族,F的质子数为C的2倍,则C为O元素,F为S元素;
元素E的最外层电子数比K层电子数多1,E应为Al元素;
B、C为同周期元素,应为第二周期元素,且与A能形成相同电子数的化合物,则B可能为C元素、也可能为N元素,根据B、C、F的质子数之和等于E、G的质子数之和,如B为C元素,则:6+8+16=13+G,G的原子序数为17,应为Cl元素,如B为N元素,则7+8+16=13+G,G的原子序数为18,为Ar元素,不属于主族元素,不符合题意,
根据元素所在周期表中的位置结合元素周期律推断元素、单质及其化合物的性质.
解答:
解:元素A的原子核内仅有一个质子,则A为H元素,A、D同主族,且A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大,可知D为Na元素,C与F同主族,F的质子数为C的2倍,则C为O元素,F为S元素,元素E的最外层电子数比K层电子数多1,应为Al元素,B、C为同周期元素,应为第二周期元素,且与A能形成相同电子数的化合物,则B可能为C元素,也可能为N元素,根据B、C、F的质子数之和等于E、G的质子数之和,如B为C元素,则6+8+16=13+G,G的原子序数为17,应为Cl元素,如B为N元素,则7+8+16=13+G,G的原子序数为18,为Ar元素,不属于主族元素,不符合题意,
(1)根据分析可知,A为H、B为C、C为O、D为Na、E为Al、F为S、G为Cl,H2O2、Na2O2、NaClO、HClO、SO2等均具有漂白性,
故答案为:SO2、Na2O2、HClO、NaClO;
(2)A分别与B、C、G能形成相应的最常见三种化合物分别为CH4、H2O、HCl,
由于H2O分子间存在氢键,其沸点高于HCl、CH4,又由于HCl的相对分子质量大于CH4,HCl的沸点高于CH4,故沸点由高到低的顺序为:H2O>HCl>CH4,
故答案为:H2O>HCl>CH4;
(3)A、C、G能形成一种3原子分子为HClO,次氯酸为共价化合物,其电子式为: ;
;
C与D能形成一种相对分子质量为78的化合物,该化合物为过氧化钠,过氧化钠为离子化合物,其电子式为: ,过氧化钠中含有的化学键为离子键和非极性键,
,过氧化钠中含有的化学键为离子键和非极性键,
故答案为: ;
; ;离子键、非极性键;
;离子键、非极性键;
(4)Al3+和Na+有相同的电子层结构,根据具有相同电子层结构的微粒,其原子序数越小离子半径越大,
可得r(Na+)>r(Al3+),Na首先与H2O反应生成NaOH:2Na+2H2O═2NaOH+H2↑,
Al再与NaOH反应刚好生成NaAlO2:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其总反应式为:Na+Al+2H2O═NaAlO2+2H2↑,
则参与反应的Na、Al的质量比为23:27,
故答案为:Na+>Al3+;23:27;Na+Al+2H2O═NaAlO2+2H2↑.
(1)根据分析可知,A为H、B为C、C为O、D为Na、E为Al、F为S、G为Cl,H2O2、Na2O2、NaClO、HClO、SO2等均具有漂白性,
故答案为:SO2、Na2O2、HClO、NaClO;
(2)A分别与B、C、G能形成相应的最常见三种化合物分别为CH4、H2O、HCl,
由于H2O分子间存在氢键,其沸点高于HCl、CH4,又由于HCl的相对分子质量大于CH4,HCl的沸点高于CH4,故沸点由高到低的顺序为:H2O>HCl>CH4,
故答案为:H2O>HCl>CH4;
(3)A、C、G能形成一种3原子分子为HClO,次氯酸为共价化合物,其电子式为:
 ;
;C与D能形成一种相对分子质量为78的化合物,该化合物为过氧化钠,过氧化钠为离子化合物,其电子式为:
 ,过氧化钠中含有的化学键为离子键和非极性键,
,过氧化钠中含有的化学键为离子键和非极性键,故答案为:
 ;
; ;离子键、非极性键;
;离子键、非极性键;(4)Al3+和Na+有相同的电子层结构,根据具有相同电子层结构的微粒,其原子序数越小离子半径越大,
可得r(Na+)>r(Al3+),Na首先与H2O反应生成NaOH:2Na+2H2O═2NaOH+H2↑,
Al再与NaOH反应刚好生成NaAlO2:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其总反应式为:Na+Al+2H2O═NaAlO2+2H2↑,
则参与反应的Na、Al的质量比为23:27,
故答案为:Na+>Al3+;23:27;Na+Al+2H2O═NaAlO2+2H2↑.
点评:本题考查位置结构性子关系及应用,题目难度中等,正确推断元素的种类为解答该题的关键,注意把握元素周期表结构、元素周期律的递变规律和物质的性质.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
在150℃时,将某气态烃和氧气混合气体点燃,恢复到原来的温度和压强,发现反应前后气体的体积不变,试推断该烃的分子式可能是( )
| A、乙烷 | B、乙烯 | C、丁烷 | D、苯 |
2012年3月29日,武汉大学张俐娜教授因对“纤维素低温溶解”的开创性研究,获得2011年度安塞姆佩恩奖(国际上纤维素与可再生资源材料领域的最高奖).制备乙酸乙酯的绿色合成路线之一为:
下列说法不正确的是( )

下列说法不正确的是( )
| A、M的分子式为C6H12O6 |
| B、N的结构简式为CH3COOH |
| C、M可以发生水解反应 |
| D、乙酸乙酯和N均能和NaOH溶液发生反应 |
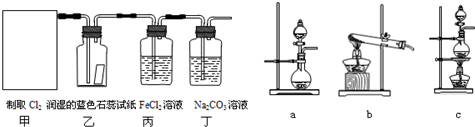
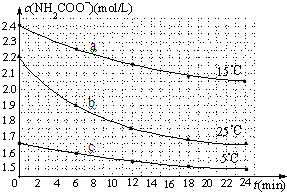 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
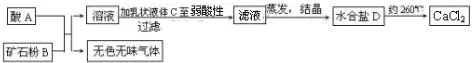
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数. 某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示:
某化工厂用氯气与氢氧化钙生产漂白粉.该厂出厂产品说明书如图所示: