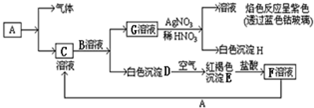
��Ŀ����
 ij��������������������������Ư�ۣ��ó�������Ʒ˵������ͼ��ʾ��
ij��������������������������Ư�ۣ��ó�������Ʒ˵������ͼ��ʾ����1��Ư�۵���Ч�ɷ���
��2������������Cl2��Դ�ڵ��ʳ��ˮ���������У�����NaOH��H2���ɣ���ҵ����ȡCl2�ķ���ʽΪ
��3������Ư��ԭ���ǣ��û�ѧ����ʽ��ʾ��
��4�����ܷ�ܹⱣ�������������������䡱����ΪƯ����Ч�ɷ��������CO2��H2O��Ӧ���ɲ��ȶ��Ĵ��������ʧЧ�����ɴ�����Ļ�ѧ����ʽΪ
���㣺�ȡ��塢�⼰�仯������ۺ�Ӧ��,��ѧ����ʽ����д
ר�⣺
��������1��Ư�۵���Ҫ�ɷ��Ǵ�����ƺ��Ȼ��ƣ���Ч�ɷ��Ǵ�����ƣ�
��2����ҵ�õ��NaCl��Һ�ķ����Ʊ���������������������Ӧ���������������ŵ�����������
��3����ҵ��ʯ�����������Ӧ�Ʊ�Ư�ۣ�
��4��Ư���к���Ca��ClO��2����������е�ˮ�Ͷ�����̼��Ӧ���ɲ��ȶ���HClO�����ʣ�
��2����ҵ�õ��NaCl��Һ�ķ����Ʊ���������������������Ӧ���������������ŵ�����������
��3����ҵ��ʯ�����������Ӧ�Ʊ�Ư�ۣ�
��4��Ư���к���Ca��ClO��2����������е�ˮ�Ͷ�����̼��Ӧ���ɲ��ȶ���HClO�����ʣ�
���
�⣺��1�����ڴ���������Ա�̼����������������������̼��ˮ��Ӧ������Ư�۾���Ư���Ե�ԭ���ǣ�Ca��ClO��2+CO2+H2O=CaCO3+2HClO��HClO����Ư���ԣ�����Ч�ɷ�ΪCa��ClO��2���ʴ�Ϊ��Ca��ClO��2��
��2����ҵ�õ��NaCl��Һ�ķ����Ʊ�����������ʽΪ2NaCl+2H2O
2NaOH+H2��+Cl2�����ʴ�Ϊ��2NaCl+2H2O
2NaOH+H2��+Cl2����
��3����ҵ��ʯ�����������Ӧ�Ʊ�Ư�ۣ���Ӧ�ķ���ʽΪ2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2H2O��
��4��Ư���к���Ca��ClO��2����������е�ˮ�Ͷ�����̼��Ӧ���ɲ��ȶ���HClO����Ӧ�ķ���ʽΪCa��ClO��2+CO2+H2O�TCaCO3��+2HClO������������ֽ�������������������ʣ�
�ʴ�Ϊ��CO2+Ca��ClO��2+H2O�TCaCO3��+2HClO��
��2����ҵ�õ��NaCl��Һ�ķ����Ʊ�����������ʽΪ2NaCl+2H2O
| ||
| ||
��3����ҵ��ʯ�����������Ӧ�Ʊ�Ư�ۣ���Ӧ�ķ���ʽΪ2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2H2O��
�ʴ�Ϊ��2Ca��OH��2+2Cl2�TCaCl2+Ca��ClO��2+2H2O��
��4��Ư���к���Ca��ClO��2����������е�ˮ�Ͷ�����̼��Ӧ���ɲ��ȶ���HClO����Ӧ�ķ���ʽΪCa��ClO��2+CO2+H2O�TCaCO3��+2HClO������������ֽ�������������������ʣ�
�ʴ�Ϊ��CO2+Ca��ClO��2+H2O�TCaCO3��+2HClO��
���������⿼��Ư�۵����ʡ��Ʊ���Ӧ�ã�ΪԪ�ػ������г��������⣬�����ڻ���֪ʶ�Ŀ��飬ע��������ʵ��Ʊ��������Լ�Ӧ�ã�ѧϰ��ע����ػ���֪ʶ�Ļ��ۣ���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
�����й�˵����ȷ���ǣ�������
| A����ȡ����������ͨ©������� |
| B��Ũ�ռ�Һմ��Ƥ����Ӧ������ϡ�����ϴ |
| C��������ƿ���ƺ�һ��Ũ�ȵ�ij��Һ����Һ����������ƿ�в����ϱ�ǩ |
| D����δ֪Һ����������ζʱ��Ӧ�ý��Լ�ƿ�ھ���ڱ�ԶһЩ���������ᓁ�� |
����������ȷ���ǣ�������
| A�������½�ϡ��ˮ��μ���ϡ�����У�����ҺpH=7ʱ��c��SO42-����c��NH4+�� | ||
| B����������Һ����ˮ�������c��H+��=10-5mol/Lʱ�����ʿ��������� | ||
| C��������pH=11��NaOH��Һ��pH=3�Ĵ�����Һ�������ϣ���Һ�ʼ��� | ||
D���������ϡ��Һ�мӴ����ƹ��壬
|
���������ҹ���--�����еIJ��ֹ������Ѹ�����Ȼ����ȼ�ϣ�����������ҪĿ���ǣ�������
| A�����ͳɱ� |
| B���Ӵ������� |
| C������CO2���ŷ��� |
| D�����ٶԿ�������Ⱦ |
����Һ��pH��4������Һ��pH��5������Һ������Һ��c��H+��֮��Ϊ��������
| A��10��1 | B��1��10 |
| C��2��1 | D��1��2 |