题目内容
14.滴定分析中,称样量在0.1g以上,相对含量大于1%的分析称为( )| A. | 微量分析 | B. | 半微量分析 | C. | 痕量分析 | D. | 常量分析 |
分析 A.微量分析一般指试样重量为0.1-10mg或体积为0.01-1ml的化学分析;
B.半微量分析是介于常量分析和微量分析之间的一种分析方法,被测物质的取样质量为0.005~0.1克,按取样体积为0.1~1.0毫升;
C.痕量分析包括测定痕量元素在试样中的总浓度,和用探针技术测定痕量元素在试样中或试样表面的分布状况.一般分成3 个基本步骤:取样、样品预处理和测定;
D.常量分析指的是被测试样的量m>0.1g或者V>10ml的分析,组分含量为1-100%;
解答 解:依据分析可知滴定分析中,称样量在0.1g以上,相对含量大于1%的分析称为常量分析,
故选D.
点评 本题考查了分析化学中的常量分析、微量分析、痕量分析和半微量分析的区分和判断,注意知识的积累,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列反应的离子方程式书写正确的是( )
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
5.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 7.8gNa2O2和Na2S混合物中含有的阴离子数目为0.1NA | |
| B. | pH=13的氢氧化钾溶液,含K+数目约为0.1NA | |
| C. | 标准状况下,5.6LO2作为氧化剂时转移的电子数一定为NA | |
| D. | 18gD2O所含电子数目为10NA |
2.短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
19.下列图象能正确表示化学实验的进程或结果的是( )
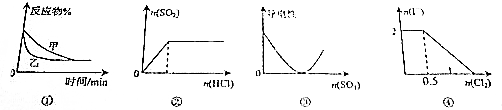

| A. | 图①表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| B. | 图②表示一定浓度的Na2SO3溶液中滴加稀盐酸,生成SO2与HCl的物质的量的关系 | |
| C. | 图③表示在Ba(OH)2溶液中加入SO3至过量的过程中溶液导电性的变化 | |
| D. | 图④表示在1L 1mol•L-1FeI2溶液中,通入Cl2时I-物质的量的变化 |
6.在1.01×105Pa、200℃下,将乙烯、乙醇、乙酸乙酯的混合气vL(已换算成标准状况,下同)在足量的氧气中充分燃烧后,恢复至1.01×105Pa、200℃,测得生成nL混合气(CO2与H2O),消耗氧气mL,下列关系正确的是( )
| A. | v>n | B. | m>n | C. | v<m | D. | 不能确定 |
6.下列说法正确的是( )
| A. | 有机物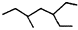 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |
7.下列关于N元素在海洋中的循环(如图所示)说法正确的是( )
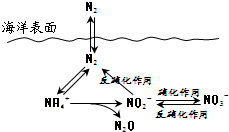

| A. | 反硝化作用中N元素均被氧化 | |
| B. | N元素所形成的化合物均易溶于水 | |
| C. | N2性质活泼可与多种物质发生反应 | |
| D. | 向海洋排放含NO3-的废水可能影响海洋中N元素循环 |
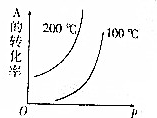 对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
对于可逆反应:mA(g)+nB(g)?pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答: