题目内容
6.下列说法正确的是( )| A. | 有机物 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |
分析 A.烃基的编号错误;
B.CH3COOH可与碳酸钠反应,CH3CH2OH溶于水,C6H6、C6H5NO2都不溶于水,但密度大小不同;
C.等质量的烃,含氢量越高耗氧量越高;
D.油脂、单糖、二糖不是高分子化合物.
解答 解:A.烃基的编号错误,应为3-甲基-5-乙基庚烷,故A错误;
B.碳酸钠与乙酸能反应生成二氧化碳,和乙醇溶液能互溶,和苯混合后不反应,但油状液体在上层,和硝基苯不反应,但油状液体在下层,故能鉴别开,故B正确;
C.烃中含氢量越大,质量不变时消耗的氧气的量越大,等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次减少,故C错误;
D.高分子化合物的相对分子质量在10000以上,油脂、单糖、二糖不是高分子化合物,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和性质,难度不大,注意相关基础知识的积累.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
13.根据信息回答下列问题:
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
(1)认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为Na<Al<Mg(填元素符号).
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
14.滴定分析中,称样量在0.1g以上,相对含量大于1%的分析称为( )
| A. | 微量分析 | B. | 半微量分析 | C. | 痕量分析 | D. | 常量分析 |
18.下列有关电解质溶液的描述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | 25℃时,PH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| C. | 在NaHS溶液中滴入CuCl2溶液产生黑色沉淀,HS-水解程度增,pH增大 | |
| D. | 3种pH相同的溶液①CH3COONa ②NaHCO3 ③NaOH中c(Na+)的大小是①>②>③ |
15.下列说法正确的是( )
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
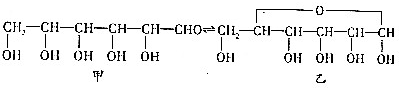
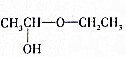 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→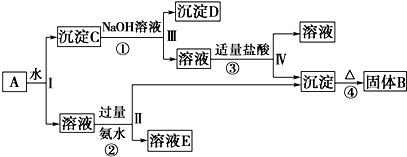
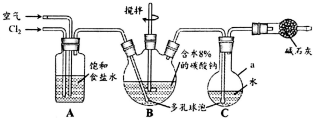 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.