题目内容
2.短周期主族元素X,Y,Z,W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X,Y的核电荷数之比为3:4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,下列说法正确的是( )| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小:X<Y,Z>W | |
| C. | 化合物Z2Y和ZWY3都只存在离子键 | |
| D. | Y,W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
分析 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,W-的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素,以此解答该题.
解答 解:短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,则X为C元素,X、Y的核电荷数之比为3:4,则Y为O元素,W-的最外层为8电子结构,W为F或Cl元素,金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应,则Z为Na元素,W只能为Cl元素,
A.X与Y形成的化合物有CO、CO2等,Z的最高价氧化物的水化物为NaOH,CO和NaOH不反应,故A错误;
B.一般说来,电子层数越多,原子半径越大,电子层数相同,质子数越多,半径越小,则原子半径大小X>Y,Z>W,故B错误;
C.化合物Z2Y和ZWY3分别为Na2O、NaClO3,NaClO3存在离子键和共价键,故C错误;
D.Y的单质臭氧,W的单质氯气,对应的化合物ClO2,可作为水的消毒剂,故D正确.
故选D.
点评 本题考查元素结构与元素周期率知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,注意把握原子结构与元素周期率的递变规律,把握物质的性质的相似性和递变性,难度中等.

练习册系列答案
相关题目
12.化学与生活、社会发展息息相关,下列有关说法不正确的是( )
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
13.根据信息回答下列问题:
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
(1)认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为Na<Al<Mg(填元素符号).
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
信息A:第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量.如图是部分元素原子的第一电离能I1随原子序数变化的曲线图(其中12号~17号元素的有关数据缺失).

信息B:不同元素的原子在分子内吸引电子的能力大小可用电负性表示.一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键.表是某些元素的电负性值:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)由图分析可知,同一主族元素原子的第一电离能I1变化规律是从上到下依次减小.
(3)图中第一电离能最小的元素在周期表中的位置是第五周期IA族.
(4)根据对角线规则,铍、铝元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是Be(OH)2+2H+=Be2++2H2O;Be(OH)2+2OH-=BeO2-+2H2O.
(5)通过分析电负性值变化规律,确定镁元素电负性值的最小范围0.93~1.57.
(6)请归纳元素的电负性和金属性、非金属性的关系是非金属性越强,电负性越大,金属性越强,电负性越小.
(7)从电负性角度,判断AlCl3是离子化合物还是共价化合物?请说出理由(即写出判断的方法和结论)Al元素和Cl元素的电负性差值为1.55<1.7,所以形成共价键,为共价化合物.
请设计一个实验方案证明上述所得到的结论将氯化铝加热到熔融态,进行导电性实验,如果不导电,说明是共价化合物.
10.X、Y、Z、W是原子序数逐渐增大的四种短周期主族元素,其原子半径如下表,已知Y、Z两种元素的单质是空气主要成分,W原子最外层电子数与Ne原子最外层电子数相差1.下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.074 | 0.099 |
| A. | Y、Z、W处于周期表中同一周期 | B. | 通常状况下得不到纯净的YZ2 | ||
| C. | X与Z形成的化合物不含非极性键 | D. | X、Z、W形成的化合物为弱酸 |
7.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为:①1.8×10-5、②5.6×10-11、③4.9×10-10、④4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
(2)常温下0.1mol/LCH3COOH溶液加水稀释过程,下列表达式数据一定变小的是A.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
①HA+HB-(少量)=A-+H2B,②H2B(少量)+C-=HB-+HC,③HA(少量)+C-=A-+HC..则三种酸对应的电离平衡常数分别为(请填空)
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(3)体积为10mLpH=2醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化分别为HX3.6、CH3COOH3.2,则HX电离平衡常数大于(填大于、等于或小于)醋酸平衡常数;理由是因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大.
14.滴定分析中,称样量在0.1g以上,相对含量大于1%的分析称为( )
| A. | 微量分析 | B. | 半微量分析 | C. | 痕量分析 | D. | 常量分析 |
15.下列说法正确的是( )
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
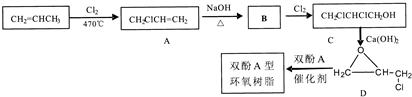
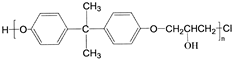
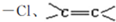 ,C的化学名称为2,3-二氯-1-丙醇.
,C的化学名称为2,3-二氯-1-丙醇.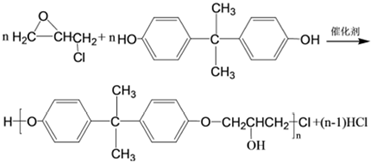
 为起始原料制备
为起始原料制备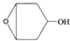 的合成路线:
的合成路线: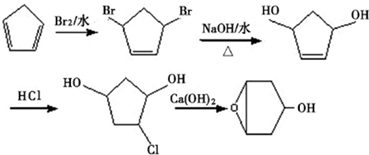 .
.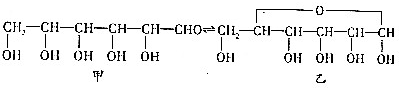
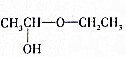 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→