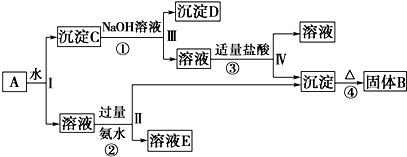
题目内容
6.在1.01×105Pa、200℃下,将乙烯、乙醇、乙酸乙酯的混合气vL(已换算成标准状况,下同)在足量的氧气中充分燃烧后,恢复至1.01×105Pa、200℃,测得生成nL混合气(CO2与H2O),消耗氧气mL,下列关系正确的是( )| A. | v>n | B. | m>n | C. | v<m | D. | 不能确定 |
分析 乙烯、乙醇、乙酸乙酯的分子式分别为C2H4、C2H6O、C4H8O2,可以改写为C2H4、C2H4.H2O、C4H4.(H2O)2,设烃的化学式为CxHy,1个该烃分子生成混合气体分子个数=x+$\frac{y}{4}$,耗氧量=x+$\frac{y}{4}$,设烃的含氧衍生物化学式为CaHbOc,1个该烃的衍生物分子生成混合气体分子个数=a+$\frac{b}{4}$,耗氧量=a+$\frac{b}{4}$-$\frac{c}{2}$,据此分析解答.
解答 解:乙烯、乙醇、乙酸乙酯的分子式分别为C2H4、C2H6O、C4H8O2,可以改写为C2H4、C2H4.H2O、C4H4.(H2O)2,设烃的化学式为CxHy,1个该烃分子生成混合气体分子个数=x+$\frac{y}{4}$,耗氧量=x+$\frac{y}{4}$,设烃的含氧衍生物化学式为CaHbOc,1个该烃的衍生物分子生成混合气体分子个数=a+$\frac{b}{4}$,耗氧量=a+$\frac{b}{4}$-$\frac{c}{2}$,
根据以上分析知,烃和烃的衍生物充分燃烧后生成混合气体分子个数大于烃及其衍生物分子个数,所以v<n;
根据烃燃烧耗氧量公式知,这几种混合气体耗氧量大于烃及烃的衍生物的量,所以v<m;
如果是烃,其耗氧量与生成气体分子物质的量相等,如果是烃的衍生物,其耗氧量小于生成混合气体分子物质的量,因为含有烃及其衍生物,所以n>m,
故选C.
点评 本题考查有机物的有关计算,为高频考点,侧重考查学生分析计算能力,明确烃及其衍生物分子式与生成混合气体分子个数、耗氧量的关系是解本题关键,注意知识的灵活运用,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
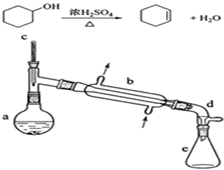
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是61%.(保留两位有效数字)
(注:产率=$\frac{实际产量}{理论产量}$×100%)

可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验所得到的环己烯产率是61%.(保留两位有效数字)
(注:产率=$\frac{实际产量}{理论产量}$×100%)
14.滴定分析中,称样量在0.1g以上,相对含量大于1%的分析称为( )
| A. | 微量分析 | B. | 半微量分析 | C. | 痕量分析 | D. | 常量分析 |
1.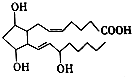 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
 前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )
前列腺素F2α(PGF2α)的结构简式如图,下列有关PGF2α说法正确的是( )| A. | PGF2α的分子式为C20H32O5 | |
| B. | 1mol PGF2α能与3molH2发生加成反应 | |
| C. | PGF2α不能使酸性高锰酸钾溶液褪色 | |
| D. | PGF2a在浓硫酸的作用下能发生酯化反应 |
18.下列有关电解质溶液的描述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | 25℃时,PH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| C. | 在NaHS溶液中滴入CuCl2溶液产生黑色沉淀,HS-水解程度增,pH增大 | |
| D. | 3种pH相同的溶液①CH3COONa ②NaHCO3 ③NaOH中c(Na+)的大小是①>②>③ |
19.甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知反应A+B=D+F,A+C=E+F;且0.1mol/L D溶液的PH为13(25°C).下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素只能形成一种二元含氧酸 | |
| C. | 另一个化合物G与B具有相同的元素组成,G是一种常见的强氧化剂 | |
| D. | 1.0L 0.1 mol/L E溶液中阴离子的总的物质的量小于0.1mol |
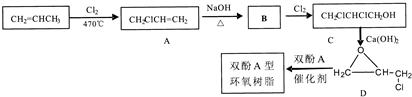
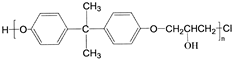
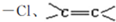 ,C的化学名称为2,3-二氯-1-丙醇.
,C的化学名称为2,3-二氯-1-丙醇.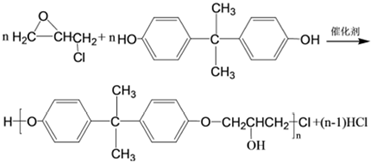
 为起始原料制备
为起始原料制备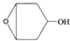 的合成路线:
的合成路线: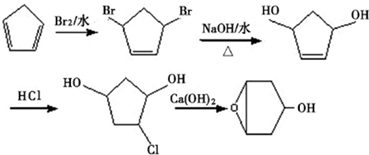 .
.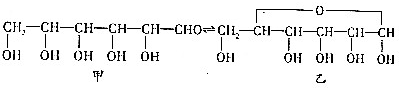
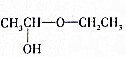 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→