题目内容
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状态下,33.6L三氧化硫中含有硫原子的数目为1.5 NA | |
| B. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5 NA | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1 NA |
分析 A、标况下三氧化硫为固体;
B、求出石墨的物质的量,然后根据1mol石墨中含0.5mol六元环来分析;
C、铜只能和浓硫酸反应,和稀硫酸不反应;
D、求出二氧化氮的物质的量,然后根据二氧化氮和水反应时,3mol二氧化氮转移2mol电子来分析.
解答 解:A、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和硫原子个数,故A错误;
B、12g石墨的物质的量为1mol,而1mol石墨中含0.5mol六元环,故含0.5NA个,故B正确;
C、铜只能和浓硫酸反应,和稀硫酸不反应,故浓硫酸不能反应完全,则生成的二氧化硫分子个数小于0.46NA个,故C错误;
D、标况下6.72L二氧化氮的物质的量为0.3mol,而二氧化氮和水反应时,3mol二氧化氮转移2mol电子,故0.3mol二氧化氮转移0.2NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列关于1S电子在原子核外出现的概率分布图(电子云)的说法中,正确的是( )


| A. | 通常用小黑点来表示电子的多少 | |
| B. | 小黑点密表示在该核外空间的电子数多 | |
| C. | 小黑点密表示在该核外空间的单位体积内电子出现的概率大 | |
| D. | 通常用小黑点来表示电子绕核作高速圆周运动 |
8.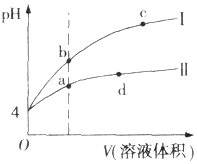 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
 常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )
常温下,pH均为4的HCl和CH3COOH溶液分别加水稀释,pH随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | pH=4的HCl溶液中H2O电离出的c(H+)=10-4 mol.L-1 | |
| B. | 曲线I为CH3COOH溶液的稀释曲线 | |
| C. | a、d点溶液和NaOH溶液完全反应时消耗的NaOH的物质的量相等 | |
| D. | a、b、c三点溶液中Kw:c=b<a |
5.下列说法不正确的是( )
| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
12.下列叙述中,不能用平衡移动原理解释的是( )
| A. | 红棕色的NO2气体,加压后颜色先变深后变浅 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 氯气在水中溶解度大于饱和食盐水中的溶解度 | |
| D. | 由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深 |
2.25℃,将pH=6的CH3COOH溶液加水稀释1 000倍后,溶液中的( )
| A. | c(H+)≈10-9 mol/L | B. | pH=9 | C. | pH≈7 | D. | c(OH-)≈10-5mol/L |
9.下列各组物质中,所含分子数不相同的是( )
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 9g H2O 和0.5mol Br2D | D. | 224mLH2 (标准状况)和0.01mol N2 |
7.莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度.已知:
滴定终点的现象是滴入最后一滴标准液时,生成砖红色沉淀,且30s内不褪色.终点现象对应的离子反应方程式为2Ag++CrO42-=Ag2CrO4↓.为了测定产品中(NH4)2Cr2O7的含量,称取样品0.150 0g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为84%. (假定杂质不参加反应,已知:①Cr2O${\;}_{7}^{2-}$+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O${\;}_{3}^{2-}$═2I-+S4O${\;}_{6}^{2-}$;②(NH4)2Cr2O7的摩尔质量为252g/moL).
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
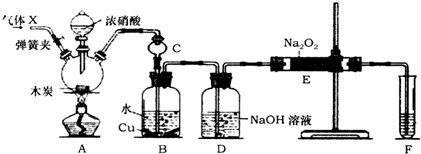
8.亚硝酸钠(NaNO2)在肉类制品加工中常用作发色剂,防腐剂.某活动小组在实验室中利用Na2O2+2NO═2NaNO2反应来制备亚硝酸钠,装置如图所示(部分夹持装置略去).
已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
具体操作:如图连接装置,检验气密性后,装入药品.实验开始前先通入常见气体X一段时间,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,直至E中淡黄色粉末完全变为白色固体.
(1)气体X的化学式为N2,其作用是排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)上述装置中,仪器C的作用是防止B中溶液倒吸.B中观察到的主要现象是铜片减小、溶液变蓝色、有气泡冒出.
(3)该活动小组制取的NaNO2产品不纯,杂质为NaOH(填化学式);为提高产品的纯度,对上述实验装置进行的改进是装置DE之间和装置EF之间添加干燥装置.
(4)请设计实验证明产品中含有NO2-取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子(简述实验操作、现象和结论).
(5)称取该小组产品4.5g溶于水配成500mL溶液,取50mL溶液于锥形瓶中,用0.1000mol•L-1的酸性KMnO4溶液进行滴定,实验数据如表所示:
第一组实验数据出现异常,造成这种异常的原因可能是abd(填字母).
a.酸式滴定管未用标准液润洗
b.锥形瓶用水洗净后又用待测液润洗
c.滴定前仰视读数,滴定终点平视读数
d.滴定结束后滴定管尖嘴处仍悬有液滴
根据表中数据,计算产品中亚硝酸钠的质量分数76.7%.

已知:①3NaNO2+3HCl═3NaCl+HNO3+2NO↑+H2O;②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+.
具体操作:如图连接装置,检验气密性后,装入药品.实验开始前先通入常见气体X一段时间,然后关闭弹簧夹,再滴加浓硝酸,加热控制B中导管均匀地产生气泡,直至E中淡黄色粉末完全变为白色固体.
(1)气体X的化学式为N2,其作用是排尽系统内空气,以免生成的一氧化氮被空气中的氧气氧化.
(2)上述装置中,仪器C的作用是防止B中溶液倒吸.B中观察到的主要现象是铜片减小、溶液变蓝色、有气泡冒出.
(3)该活动小组制取的NaNO2产品不纯,杂质为NaOH(填化学式);为提高产品的纯度,对上述实验装置进行的改进是装置DE之间和装置EF之间添加干燥装置.
(4)请设计实验证明产品中含有NO2-取少量E中白色固体加入稀盐酸产生无色气体,遇到空气变化为红棕色证明固体中含有亚硝酸根离子(简述实验操作、现象和结论).
(5)称取该小组产品4.5g溶于水配成500mL溶液,取50mL溶液于锥形瓶中,用0.1000mol•L-1的酸性KMnO4溶液进行滴定,实验数据如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.80 | 20.01 | 20.00 | 19.99 |
a.酸式滴定管未用标准液润洗
b.锥形瓶用水洗净后又用待测液润洗
c.滴定前仰视读数,滴定终点平视读数
d.滴定结束后滴定管尖嘴处仍悬有液滴
根据表中数据,计算产品中亚硝酸钠的质量分数76.7%.