题目内容
15.下列物质的水溶液因水解而呈碱性的是( )| A. | NaOH | B. | NH4Cl | C. | CH3COONa | D. | HC1 |
分析 水溶液因水解而呈碱性,可知为强碱弱酸盐,弱酸根离子水解显碱性,以此来解答.
解答 解:A.NaOH为强碱,电离显碱性,故A不选;
B.NH4Cl为强酸弱碱盐,水解显酸性,故B不选;
C.CH3COONa为强碱弱酸盐,水解显碱性,故C选;
D.HCl为强酸,不水解,溶液显酸性,故D不选;
故选C.
点评 本题考查盐类水解,为高频考点,把握盐的类型及水解反应为解答的关键,侧重分析与应用能力的考查,注意水解原理的应用,题目难度不大.

练习册系列答案
相关题目
6.已知25℃时有关弱酸的电离平衡常数如下.下列有关说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 向冰醋酸中逐滴加水,醋酸的电离度和pH先增大后减小 | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 25℃时,在CH3COOH溶液与NaCN溶液中,水的电离程度前者大 | |
| D. | amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)<c(CN-),则b一定小于a |
3.酸雨的形成主要是由于( )
| A. | 森林遭到乱砍滥伐 | B. | 含硫化石燃料的大量燃烧 | ||
| C. | 大气中二氧化碳的含量增大 | D. | 含氮、磷的废水任意排放 |
10.下列说法正确的是( )
| A. | 具有相同质子数的微粒一定属于同一种元素 | |
| B. | H2O和H2O2互为同素异形体 | |
| C. | 含有金属元素的离子不一定是阳离子 | |
| D. | 同种元素的原子中,中子数和质子数一定都相同 |
20.相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.下列判断不正确的是( )
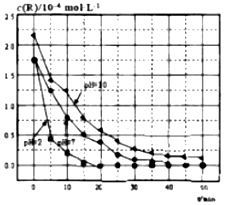

| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
7.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | 简单离子半径:W>X | |
| B. | 含氧酸的酸性:W>Z | |
| C. | 气态氢化物的稳定性:W<Y | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
4.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
19.X、Y、Z、W为短周期的四种元素,有关它们的部分信息如表所示:
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答):
(1)X单质的电子式是 .
.
(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)W、Z形成的化合物的水溶液的pH<(填“>”“<”或“=”)7,理由是Al3++3H2O?Al(OH)3+3H+ (用离子方程式表示).
(4)8g Y的最简单氢化物完全燃烧生成液态水时放出445kJ的热量,写出Y的最简单氢化物的燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1.
| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
(1)X单质的电子式是
 .
.(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>HNO3>H2CO3.
(3)W、Z形成的化合物的水溶液的pH<(填“>”“<”或“=”)7,理由是Al3++3H2O?Al(OH)3+3H+ (用离子方程式表示).
(4)8g Y的最简单氢化物完全燃烧生成液态水时放出445kJ的热量,写出Y的最简单氢化物的燃烧热的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1.