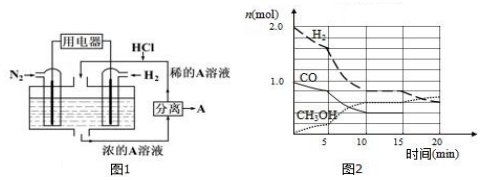
题目内容
20.相同温度下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.下列判断不正确的是( )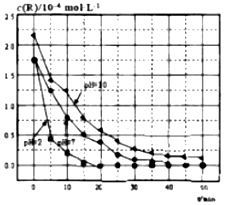
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
分析 A.反应速率为平均速率,不是瞬时速率;
B.对比pH=2和pH=7的曲线,酸性强的斜率较大;
C.根据v=$\frac{△c}{△t}$计算;
D.根据图中的信息可以知道在0-50min之间,pH=2和pH=7时R的降解百分率.
解答 解:A.反应速率为平均速率,不是瞬时速率,则不能说明在同一时刻,能说明R的起始浓度越大,降解速率越大,故A错误;
B.对比pH=2和pH=7的曲线,可知溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,故B正确;
C.v=$\frac{△c}{△t}$=$\frac{1.75×1{0}^{-4}mol/L}{20min}$=0.0875×10-4mol•L-1•min-1,故C正确;
D.根据图示可知:在0-50min之间,pH=2和pH=7时R的降解百分率都为100%,故D正确.
故选A.
点评 本题考查了化学平衡的影响因素,为高频考点,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握外界条件对化学平衡、化学反应速率的影响,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
10.CH4和CO2混合气体的密度与同温同压下NO的密度相同,混合气体中CH4和CO2的质量比为( )
| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
11.化学与生产、生活、科技等密切相关,下列说法不正确的是( )
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
8.下列说法正确的是( )
| A. | 镁带燃烧可以用CO2灭火 | |
| B. | 单晶硅是重要的半导体材料,常用于制造光导纤维 | |
| C. | Cl2能使湿润的有色布条褪色,是因为Cl2的氧化性 | |
| D. | 金属钠可保存在煤油中 |
15.下列物质的水溶液因水解而呈碱性的是( )
| A. | NaOH | B. | NH4Cl | C. | CH3COONa | D. | HC1 |
5.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
12.X、Y、Z、W为原子序数依次增大的短周期主族元素,Y与W同主族.物质A、B、C均由其中三种元素组成,且为中学常见强电解质,可发生反应A+2B═C+2H2O.下列推断正确的是( )
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |
3.有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)氧化成硫酸盐.运用该原理生产铜和绿矾(FeSO4•7H2O)的流程如图:
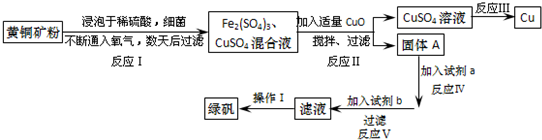
回答下列问题:
(1)已知:
加入CuO将溶液的pH调节到约为4,结合平衡移动原理解释该操作的原因Fe3+在溶液中存在存在平衡Fe3++3H2O?Fe(OH)3+3H+,加入CuO消耗溶液中的H+,使c(H+)减小,使Fe3+转化为Fe(OH)3沉淀而除去,不损耗铜离子且不引入杂质.
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.

回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.