题目内容
10.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出.目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
分析 (1)SO2 是酸性氧化物,二氧化硫与氢氧化钠反应生成亚硫酸钠和水;
(2)①由表格中的数据可知,HSO3-越多,酸性越强,则电离生成氢离子;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,结合电荷守恒解答.
解答 解:(1)SO2 是酸性氧化物,能与碱反应生成盐与水,二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,
故答案为:2OH-+SO2═SO32-+H2O;
(2)①由表格中的数据可知,溶液呈酸性,HSO3-越多,酸性越强,是因为溶液中存在:HSO3?SO32-+H+; HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,溶液显酸性,
故答案为:酸;溶液中存在:HSO3-?SO32-+H+ HSO3-+H2O?H2SO3+OH- 电离程度大于水解程度,故溶液显酸性;
②吸收液呈中性时,溶质为亚硫酸钠和亚硫酸氢钠,电离与水解的程度相等,
a.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),c(SO32-)≠c(H2SO3),故a错误;
b.SO32-+H2O?HSO3-+OH-,HSO3-?H++SO32-,亚硫酸两步水解,则离子浓度为c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),故b正确;
c.由电荷守恒可知,c(H+)+c(Na+)═2c(SO32-)+c(HSO3-)+c(OH-),中性溶液则c(H+)═c(OH-),则c(Na+)═2c(SO32-)+c(HSO3-),故c正确;
故答案为:bc.
点评 本题考查了水解原理、离子浓度定性比较的理解和计算应用,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
(2)该同学推测铝热反应所得到的熔融物应是铁铝合金,理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?答:合理(填“合理”或“不合理”).请写出铝热反应的一种工业用途焊接钢轨、冶炼难熔金属、定向爆破.
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(4)实验室要溶解该熔融物,下列试剂中可以选用BC(填序号).
A.浓硫酸 B.稀硫酸C.稀硝酸 D.氢氧化钠溶液.
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. |  世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物总质量之比 | |
| D. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 |
| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8g |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 加入BaCl2溶液,看是否有沉淀生成 | B. | 将水加热煮沸,看是否有沉淀生成 | ||
| C. | 加入NaOH溶液,看是否有沉淀生成 | D. | 加入少量肥皂水,看是否有沉淀 |
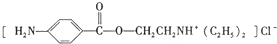 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: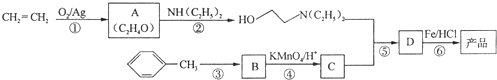
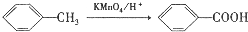
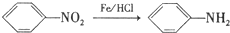

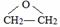 .
.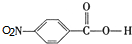 ,C中含有的含氧官能团的名称为硝基、羧基.
,C中含有的含氧官能团的名称为硝基、羧基.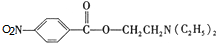 +H2O.
+H2O.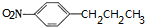 (任写一种).
(任写一种).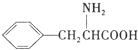 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式 .
.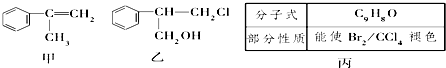
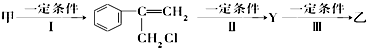
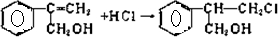 (不需注明反应条件).
(不需注明反应条件).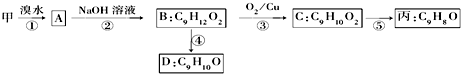
 .
. 、
、 、
、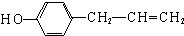 (任写一种).
(任写一种).