题目内容
20.某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-=HClO+CH3COO- | |
| C. | 该消毒液与洁厕灵(成分为HCl)混用,产生Cl2:2H++Cl-+ClO-=Cl2↑+H2O | |
| D. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH- |
分析 A.反应生成氯化钠、次氯酸钠和水;
B.白醋生成HClO,发生强酸制取弱酸的反应;
C.消毒液与洁厕灵混合,发生氧化还原反应生成氯气;
D.消毒液的pH约为12,与含NaOH有关.
解答 解:A.反应生成氯化钠、次氯酸钠和水,用NaOH溶液吸收Cl2制备的离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故A正确;
B.白醋生成HClO,发生强酸制取弱酸的反应,离子反应为CH3COOH+ClO-=HClO+CH3COO-,故B正确;
C.消毒液与洁厕灵混合,发生氧化还原反应生成氯气,离子反应为2H++Cl-+ClO-=Cl2↑+H2O,故C正确;
D.饱和NaClO溶液的pH约为11,而该消毒液的pH约为12,与含NaOH有关,NaOH=Na++OH-,故D错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,综合性较强,题目难度不大,注意离子反应中保留化学式的物质及电子、电荷守恒.

练习册系列答案
相关题目
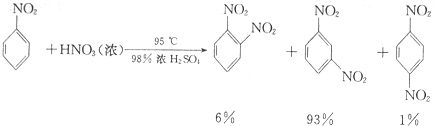
8. 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1) +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O
(2)可能用到的有关数据列表如下
请回答下列问题:
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为70%(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是停止加热,待冷却后加入.
 硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下:①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50-60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.
已知(1)
 +HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$
+HNO3(浓)$→_{98%浓H_{2}SO_{4}}^{50-60℃}$ +H2O
+H2O 
(2)可能用到的有关数据列表如下
| 物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 1,3-二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
(1)配置混酸应先在烧杯中先加入浓硝酸.
(2)恒压滴液漏斗的优点是可以保持漏斗内压强与发生器内压强相等,使漏斗内液体能顺利流下.
(3)实验装置中长玻璃管可用冷凝管(球形冷凝管或直行冷凝管均可)代替(填仪器名称).
(4)反应结束后产品在液体的下层(填“上”或者“下”),分离混酸和产品的操作方法为分液.
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?取最后一次洗涤液,向溶液中加入氯化钙,无沉淀生成,说明已洗净.
(6)为了得到更纯净的硝基苯,还须先向液体中加入氯化钙除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为70%(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是停止加热,待冷却后加入.
5.关于下列各图的叙述,正确的是( )
| A. | 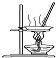 用图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. |  图装置可用于收集H2、NH3、NO等气体 | |
| C. | 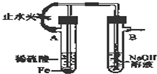 图装置能较长时间观察到Fe(OH)2白色沉淀 | |
| D. |  图能比较MnO2、Cl2、I2的氧化性 |
12.下列叙述中正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
9.下列说法中正确的是( )
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 所有物质之间均存在化学键 | |
| C. | 由非金属元素可以组成离子化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
10.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出.目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
①由如表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在:HSO3-?SO32-+H+HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,故溶液显酸性.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
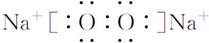 .
. ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.