题目内容
9.检验水是否为硬水的简便方法是( )| A. | 加入BaCl2溶液,看是否有沉淀生成 | B. | 将水加热煮沸,看是否有沉淀生成 | ||
| C. | 加入NaOH溶液,看是否有沉淀生成 | D. | 加入少量肥皂水,看是否有沉淀 |
分析 硬水是指含有较多钙镁离子的水,软水是指含有较少钙镁离子的水,据此分析.
解答 解:硬水和软水的区别在于所含的钙镁离子的多少,生活中可用肥皂水来区分硬水和软水,产生泡沫较多的是软水,较少的硬水,
故选D.
点评 本题考查了离子检验、化学知识在生活中的应用,题目难度不大,侧重于考查学生对基础知识的应用能力.

练习册系列答案
相关题目
10.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出.目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
①由如表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在:HSO3-?SO32-+H+HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,故溶液显酸性.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
8.常温下,在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L 盐酸40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示.下列说法不正确的是( )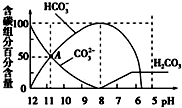

| A. | 0.1 mol/L Na2CO3溶液中c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当加入20 mL盐酸时,混合溶液的pH约为8 | |
| C. | 常温下CO2饱和溶液的pH约为5.6 | |
| D. | 在A点:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
14.下列化学用语表示正确的是( )
| A. | 硫原子的结构示意图: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 二氧化碳分子的电子式: | |
| D. | 硫酸钠的电离方程式:Na2SO4═2Na++SO42- |
1.下列各组中两种微粒所含电子数不相等的是( )
| A. | H3O+和OH - | B. | CO和N2 | C. | HNO2和NO2- | D. | CO2和NO2 |
18.下列关于平衡常数的说法中,正确的是( )
| A. | 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示 | |
| B. | 平衡常数越大,表示化学反应速率越大 | |
| C. | 可以用化学平衡常数来定量描述化学反应的限度 | |
| D. | 平衡常数的大小与温度、浓度、压强、催化剂有关 |
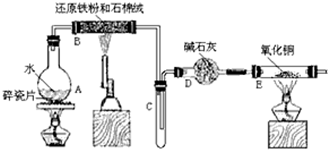
19.Si3N4是一种重要的新型无机非金属材料,能被强碱腐蚀;实验室可利用SiCl4蒸气和NH3在1400℃、无水、无氧条件下反应制取氧化硅,实验装置示意图(加热和夹持装置略去)和有关性质如下:

请回答下列问题:
(1)装置B中所加入的试剂名称为碱石灰.
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为药品受热均匀,容易控制温度.
(3)反应开始前先组装好仪器,检查装置的气密性(填操作步骤)后,再加装药品,接下来的操作是③②①(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4 ②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl.
(5)反应过程中,装置E中的现象为有无色液体生成,并产生白烟.
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000mol•L-1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500mol•L-1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为Si3N4+6OH-+3H2O=3SiO32-+4NH3↑.
②产品中Si3N4的质量分数为9.10%(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为NH4F.

| 物质 | 熔点/℃ | 沸点/℃ | |
| SiCl4 | -70 | 57.7 | 难溶解NH3和无机盐,在潮湿空气中极易水解 |
| Si3N4 | 1900 | - | 性质稳定 |
(1)装置B中所加入的试剂名称为碱石灰.
(2)装置C中的锥形瓶需要热水浴,热水浴加热的优点为药品受热均匀,容易控制温度.
(3)反应开始前先组装好仪器,检查装置的气密性(填操作步骤)后,再加装药品,接下来的操作是③②①(请按正确的顺序填写下列步骤的序号).
①滴加SiCl4 ②加热装置D ③加热装置A
(4)装置D中发生反应的化学方程式为3SiCl4+4NH3$\frac{\underline{\;1000℃\;}}{\;}$Si3N4+12HCl.
(5)反应过程中,装置E中的现象为有无色液体生成,并产生白烟.
(6)测定产品中 Si3N4的含量,步骤为:
ⅰ.反应结束后,取200.0g装置D中的物质,加入足量NaOH溶液,充分加热反应;
ⅱ.将生成的气体全部被200.0mL3.000mol•L-1盐酸吸收(溶液体积变化忽略不计);
ⅲ.取吸收后所得溶液20.00mL,用0.2500mol•L-1NaOH溶液滴定过量盐酸;
ⅳ.重复滴定3次,平均消耗NaOH溶液32.00mL.
①步骤ⅰ中发生反应的离子方程式为Si3N4+6OH-+3H2O=3SiO32-+4NH3↑.
②产品中Si3N4的质量分数为9.10%(保留3位有效数字)
(7)Si3N4抗腐蚀能力很强,但易被氢氟酸腐蚀,反应生成四氟化硅和一种铵盐,该盐的化学式为NH4F.