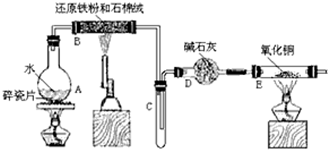
题目内容
2.下列叙述正确的是( )| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8g |
分析 A.质量的单位为g;
B.摩尔质量的单位为g•mol-1;
C.根据N=nNA=$\frac{m}{M}$×NA计算;
D.根据m=nM=$\frac{N}{{N}_{A}}$×M计算.
解答 解:A.1mol H2SO4的质量为98g,故A错误;
B.H2SO4的相对分子质量为98,H2SO4的摩尔质量为98g•mol-1,故B错误;
C.9.8 g H2SO4含有H2SO4分子N=nNA=$\frac{m}{M}$×NA=$\frac{9.8g}{98g/mol}$×NA=0.1NA,故C错误;
D.6.02×1022个H2SO4分子的质量为m=nM=$\frac{N}{{N}_{A}}$×M=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$mol×98g/mol=9.8g,故D正确;
故选D.
点评 本题考查物质的量的有关计算,题目难度不大,计算时须注意把握有关计算公式的灵活运用.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
12.下列叙述中正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
10.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出.目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
①由如表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在:HSO3-?SO32-+H+HSO3-+H2O?H2SO3+OH-电离程度大于水解程度,故溶液显酸性.
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
钠碱循环法脱硫技术.
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:SO2+2OH-=SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是(选填字母):bc.
a.c(Na+)═c(SO32-)+c(HSO32-)+c(H2SO3)
b.c(Na+)>c(HSOe-)>c(SOe2-)>c(H+)═c(OH-)
c.c(Na+)═2c(SOe2-)+c(HSOe-)
14.利用甲烷燃料电池电解饱和食盐水制备漂白液,下列说法中不正确的是( )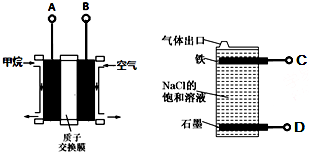

| A. | 燃料电池的A极连接电解池的C极 | |
| B. | 燃料电池工作时当0.2 NA个H+通过质子交换膜移向右边,饱和食盐水中可产生2.24L气体 | |
| C. | A电极的电极反应式为:CH4-8e-+2H2O═CO2+8H+ | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
1.下列各组中两种微粒所含电子数不相等的是( )
| A. | H3O+和OH - | B. | CO和N2 | C. | HNO2和NO2- | D. | CO2和NO2 |
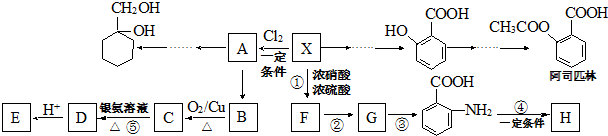
 (苯胺,易被氧化)
(苯胺,易被氧化)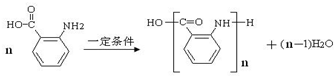 .
.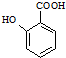 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.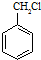 和其他无机物合成
和其他无机物合成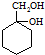 最合理的方案.
最合理的方案.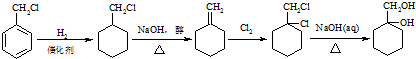 .
. ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)