题目内容
 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
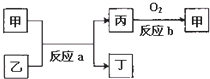
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:
考点:无机物的推断,元素周期律和元素周期表的综合应用
专题:推断题,元素周期律与元素周期表专题
分析:(1)元素②所处主族的位置为所有主族的正中间,应为ⅣA族元素,由在周期表中的位置可知应为C,则⑦为S元素,⑧为Cl元素;
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等.
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等.
解答:
解:(1)元素②所处主族的位置为所有主族的正中间,应为ⅣA族元素,由在周期表中的位置可知应为C,则⑦为S元素,⑧为Cl元素,
由此可知元素②位于周期表第二周期第IVA族,元素周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下逐渐增大,则原子半径C<Cl<S,非金属性
C<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则为HClO4>H2SO4>H2CO3,
故答案为:二;IVA; C<Cl<S;HClO4>H2SO4>H2CO3;
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等,反应的方程式为2Na+2H2O=2NaOH+H2↑或2C+SiO2
Si+2CO↑,
故答案为:2Na+2H2O=2NaOH+H2↑或2C+SiO2
Si+2CO↑.
由此可知元素②位于周期表第二周期第IVA族,元素周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下逐渐增大,则原子半径C<Cl<S,非金属性
C<S<Cl,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则为HClO4>H2SO4>H2CO3,
故答案为:二;IVA; C<Cl<S;HClO4>H2SO4>H2CO3;
(2)单质乙与单质丙所含元素位于同一主族,且反应为置换反应,由反应b可知甲为氧化物,应为单质和氧化物之间的置换反应,常见有Na+H2O→NaOH+H2,C+SiO2→Si+CO等,反应的方程式为2Na+2H2O=2NaOH+H2↑或2C+SiO2
| ||
故答案为:2Na+2H2O=2NaOH+H2↑或2C+SiO2
| ||
点评:本题考查较为综合,涉及元素周期表与元素周期律以及无机物的推断,侧重于学生的分析能力的考查,为高频考点,注意把握题给信息以及常见元素化合物的性质,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.56L甲烷中含有的共价键数为0.1NA |
| B、标准状况下,1mol SO3含有的氧原子数为3NA |
| C、含1mol AlCl3的溶液中,Al3+总数为NA |
| D、pH=1的稀硫酸中含有的H+数为0.1NA |
下列用来表示物质变化的反应式中,错误的是( )
| A、钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-═4OH- |
| B、向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+H++Ba2++OH-═BaSO4↓+H2O |
| C、明矾水解的离子方程式:Al3++3H2O?Al(OH)3+3H+ |
| D、K37ClO3与浓盐酸(HCl)在加热时生成氯气:K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
下列有关化学用语及其叙述,不正确的是( )
| A、乙烯分子的结构简式:CH2=CH2 | ||||
B、
| ||||
C、氟离子结构示意图: | ||||
D、丙烷分子的球棍模型: |
下列有关实验或操作的叙述正确的是( )
A、实验室可采用如图所示装置制取氨气 |
| B、用分液漏斗从石油里分离出汽油、煤油和石蜡 |
| C、用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质 |
| D、用碱式滴定管盛装KMnO4溶液滴定FeSO4溶液 |
下列各溶液中,微粒的物质的量浓度关系不正确的是( )
| A、c(NH4+)相等的(NH4)2SO4溶液和(NH4)2CO3溶液 c[(NH4)2SO4]<[(NH4)2CO3] |
| B、0.1mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| C、0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) |
| D、10mL0.5mol/L CH3COONa溶液与6mL1mol/L盐酸混合 c(Cl-)>c(Na+)>c(OH-)>c(H+) |
下列各组离子在溶液中能够大量共存,当溶液中的pH=1时,有气体产生;而当溶液中的pH=13时,又能生成沉淀.则该组离子可能是( )
A、Na+、K+、Al
| ||||
B、Fe2+、Na+、S
| ||||
C、Mg2+、N
| ||||
D、Ba2+、K+、Cl-、Mn
|

