题目内容
下列各组离子在溶液中能够大量共存,当溶液中的pH=1时,有气体产生;而当溶液中的pH=13时,又能生成沉淀.则该组离子可能是( )
A、Na+、K+、Al
| ||||
B、Fe2+、Na+、S
| ||||
C、Mg2+、N
| ||||
D、Ba2+、K+、Cl-、Mn
|
考点:离子共存问题
专题:
分析:根据离子之间不能结合生成水、气体、沉淀,则离子能大量共存,结合当溶液中的pH=1时,有气体产生;而当溶液中的pH=13时,又能生成沉淀,以此来解答.
解答:
解:A.该组离子之间不能反应,能共存,酸性条件下生成二氧化碳气体,碱性条件下没有沉淀生成,故A不选;
B.该组离子之间不能反应,能共存,酸性条件下Fe2+、H+、NO3-发生氧化还原反应生成NO,碱性溶液中生成氢氧化亚铁沉淀,故B选;
C.Mg2+、CO32-结合生成沉淀,不能共存,故C错误;
D.该组离子之间不能反应,能共存,但碱性条件下没有沉淀生成,故D不选;
故选B.
B.该组离子之间不能反应,能共存,酸性条件下Fe2+、H+、NO3-发生氧化还原反应生成NO,碱性溶液中生成氢氧化亚铁沉淀,故B选;
C.Mg2+、CO32-结合生成沉淀,不能共存,故C错误;
D.该组离子之间不能反应,能共存,但碱性条件下没有沉淀生成,故D不选;
故选B.
点评:本题考查离子的共存,为高考高频考点,把握习题中的信息及离子之间的反应为解答的关键,注意酸碱条件下的离子反应,题目难度不大.

练习册系列答案
相关题目
下列离子方程式或化学反应方程式与所述事实相符且正确的是( )
| A、将2mol SO3气体通入一密闭容器中,反应达平衡后吸收QkJ热量,则该反应的热化学方程式为:2SO3(g)?2SO2(g)+O2(g)△H=+Q kJ/mol |
| B、向0.1mol?L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O |
| C、以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O═2Cu+O2↑+4H+ |
| D、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、5.6g铁片投入到冷的浓硫酸中,铁片失去电子数为0.3NA |
| B、60g二氧化硅(SiO2)中含有的Si-O键为4NA |
| C、标准状况下,3g NO与1.6gO2混合气体所含有的分子数为0.1NA |
| D、标准状况下,5.6L四氯化碳含有的分子数为0.25 NA |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、1.0L 1.0mol/LNaAlO2水溶液中含有的氧原子数为2NA |
| B、12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| C、25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
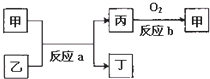 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
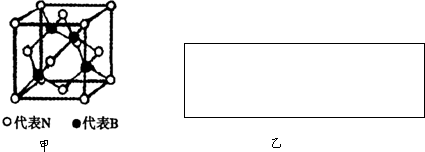
 热敏电阻PTC元件的主要成分为钡钛矿,其晶体结构如图所示,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定:重复单位为正方体,边长为403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
热敏电阻PTC元件的主要成分为钡钛矿,其晶体结构如图所示,该结构是具有代表性的最小重复单位.该晶体经X射线分析鉴定:重复单位为正方体,边长为403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.