题目内容
已知反应mx(g)+ny(g)?qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
| A、通入稀有气体使压强增大,平衡向正反应方向移动 |
| B、x的正反应速率是y的逆反应速率的n/m倍 |
| C、降低温度,混合气体的平均相对分子质量变大 |
| D、增加X的物质的量,y的转化率降低 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变;
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比;
C、降低温度平衡向正反应移动,由于m+n>q,反应混合气体总的物质的量减小,结合M=
判断;
D、反应物的起始物质的量之比等于化学计量数之比转化率相同.
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比;
C、降低温度平衡向正反应移动,由于m+n>q,反应混合气体总的物质的量减小,结合M=
| m |
| n |
D、反应物的起始物质的量之比等于化学计量数之比转化率相同.
解答:
解:A、恒容条件下,通入稀有气体使压强增大,反应混合物的浓度不变,正、逆反应速率不变,平衡不移动,故A错误;
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比,X的正反应速率是Y的逆反应速率的
倍,说明反应到达平衡,故B错误;
C、降低温度平衡向正反应移动,由于m+n>q,反应混合气体总的物质的量减小,混合气体总质量不变,结合M=
可知混合气体的平均摩尔质量增大,故降低温度,混合气体的平均相对分子质量增大,故C正确;
D、反应物的起始物质的量之比等于化学计量数之比转化率相同,平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为m:n,故D错误,
故选C.
B、可逆反应达平衡时不同物质表示的正、逆反应速率之比等于化学计量数之比,X的正反应速率是Y的逆反应速率的
| m |
| n |
C、降低温度平衡向正反应移动,由于m+n>q,反应混合气体总的物质的量减小,混合气体总质量不变,结合M=
| m |
| n |
D、反应物的起始物质的量之比等于化学计量数之比转化率相同,平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为m:n,故D错误,
故选C.
点评:本题考查化学平衡移动的影响因素、化学平衡状态的判断等,难度中等,A为易错点,注意压强的变化不能引起浓度的变化化学平衡不移动,反应前后气体的体积不变化,即使引起浓度不变,但化学平衡不移动.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
两种金属粉末的混合物52g,溶于足量的稀H2SO4中,生成标准状况下的氢气22.4L,则这种混合物不可能是( )
| A、Na和K | B、Mg和Al |
| C、Zn和Mg | D、Al和Fe |
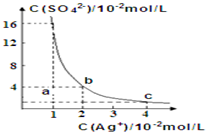 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示:下列有关Ag2SO4说法正确的是( )| A、含有大量SO42-的溶液中肯定不存在Ag+ |
| B、Ag2SO4的溶度积常数(Ksp)为8×10-4 |
| C、a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| D、0.02mol?L-1的AgNO3溶液与0.2mol?L-1的Na2SO4溶液等体积混合不会生成沉淀 |
某温度下,密闭容器中发生反应aX(g)?bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质X的浓度是原来的1.8倍.则下列叙述正确的是( )
| A、可逆反应的化学计量数:a<b+c |
| B、压缩容器的容积时,v正增大,v逆减小 |
| C、达到新平衡时,Y,Z浓度增大,K值变大 |
| D、达到新平衡后,保持容器体积不变,加入物质X平衡正向移动,X的转化率增大 |


