题目内容
7.ClO2气体是一种高效、广谱、安全的杀菌消毒剂,可用NaClO3和草酸(H2C2O4)反应制得.无水草酸100℃可以升华.某学习小组用图1装置模拟工业制取收集ClO2.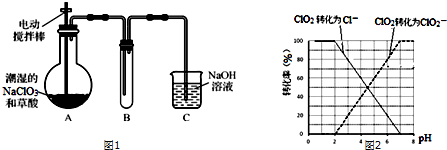
(1)实验时装置A需在60℃~100℃进行的原因是温度过低,化学反应速率较慢,温度过高草酸升华或分解,控制所需温度的方法是水浴加热.
(2)电动搅拌棒的作用是将反应物充分混合(或充分反应、或使反应物受热均匀).装置A中反应产物有Na2CO3、ClO2和CO2等,该反应的化学方程式为2NaClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+2ClO2↑+H2O.
(3)在装置C中ClO2和NaOH反应生成等物质的量的两种盐,其中一种盐为NaClO2,写出反应的离子方程式2ClO2+2OH-=ClO3-+ClO2-+H2O.
(4)用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根离子(ClO2-).
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示
②当pH≤2.0时,ClO2-也能被I-还原成Cl-
③2Na2S2O3+I2=Na2S4O6+2NaI
根据上述信息,请补充完整测定饮用水中ClO2-含量的实验方案:
取一定体积的饮用水,加入NaOH溶液调节pH为7.0~8.0;加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积;再重复上述操作1~2次,计算得出结果.
(实验中需使用的试剂:淀粉溶液、标准Na2S2O3溶液、KI溶液、稀硫酸)
分析 实验过程分析:装置A中盛放草酸和NaClO3,反应生成ClO2气体:2NaClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+2ClO2↑+H2O,装置A用电动搅拌棒,将反应物充分混合(或充分反应、或使反应物受热均匀),B为ClO2的凝集装置,装置C为尾气吸收装置.
(1)无水草酸100℃可以升华所以反应温度低于100℃,温度过低,反应速率慢,所以实验时装置A需在60℃~100℃进行,60℃~100℃反应,需要用水浴加热;
(2)电动搅拌可让让反应物充分的接触,加快反应速率;装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,根据反应物和生成物书写化学方程式;
(3)NaOH吸收ClO2,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,根据氧化还原反应规律来书写;
(4)题目信息提示用的是连续碘量法进行测定,信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,结合pH≤2.0时,ClO2-与I-反应的离子方程式可判断出调节溶液的pH≤2.0,据此设计测定饮用水中ClO2-含量的实验方案.
解答 解:(1)一般来说,升高温度,活化分子的百分数增大,反应速率增大,温度过低,化学反应速率较慢,无水草酸100℃可以升华,温度过高草酸升华或分解,所以实验时装置A需在60℃~100℃进行,反应温度低于水的沸点,用水浴可使反应容器受热均匀,所以反应要用水浴加热,
故答案为:温度过低,化学反应速率较慢,温度过高草酸升华或分解;水浴加热;
(2)实验时电动搅拌,能增加反应物的接触机会,将反应物充分混合(或充分反应、或使反应物受热均匀),使反应速率加快,装置A中反应物为NaClO3、H2C2O4,产物有Na2CO3、ClO2和CO2等,Cl(+5→+4),C(+3→+4),根据得失电子守恒和原子守恒,该反应方程式为:2NaClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+2ClO2↑+H2O,
故答案为:将反应物充分混合(或充分反应、或使反应物受热均匀);2NaClO3+H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+2ClO2↑+H2O;
(3)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2-,氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3-,反应的离子方程式为:2ClO2+2OH-=ClO3-+ClO2-+H2O,
故答案为:2ClO2+2OH-=ClO3-+ClO2-+H2O;
(4)信息③用Na2S2O3溶液滴定至终点,说明步骤中有碘生成,是用连续碘量法进行测定,根据曲线图示在pH≤2.0时,ClO2被I-还原只生成Cl-,pH≥7.0时,ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品水样中亚氯酸根离子的含量,所以需调节溶液的pH≤2.0,所以测定饮用水中ClO2-含量的实验方案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积,
故答案为:加入足量KI溶液,加2滴淀粉溶液;用标准Na2S2O3溶液滴定至终点(或蓝色褪去),记录消耗标准Na2S2O3溶液的体积;加入稀硫酸调节溶液的pH≤2.0;继续用标准Na2S2O3溶液滴定至终点,记录消耗标准Na2S2O3溶液的体积.
点评 本题考查实验方案的设计,为高频考点,把握制备的反应原理及测定含量发生的反应为解答的关键,侧重分析、实验能力的综合考查,题目难度中等.

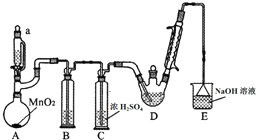 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH (三氯乙酸)+HCl
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -1 14.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物Cl3CCOOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,可采用蒸馏的方法从D中的混合物分离出CCl3COOH,除酒精灯、接液管、温度计、锥形瓶外,所需玻璃仪器有蒸馏烧瓶、冷凝管.
(4)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol/L碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.0200mol/LNa2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(保留3位有效数字)
滴定的反应原理:
CCl3CHO+OH-→CHCl3+HCOO-
HCOO-+I2→H++2I-+CO2↑
I2+2S2O32-→2I-+S4O62-
(5)请设计实验方案证明三氯乙酸的酸性比乙酸强:分别测定0.1mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,说明三氯乙酸酸性比乙酸的强.
| A. | M的氢化物的水溶液能与W的钠盐溶液,反应得到W的氢化物,说明非金属性M>W | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(Y) | |
| C. | Y与Z形成的化合物能与碱反应,但不能和任何酸反应 | |
| D. | X和Y,W和M均能形成原子个数比为1:1的分子 |
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: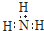 | |
| C. | 苯乙酸钠的结构简式: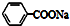 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
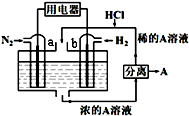 以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )| A. | b电极为负极,发生氧化反应 | |
| B. | a电极发生的反应为N2+8H++6e-=2NH4+ | |
| C. | A溶液中所含溶质为NH4Cl | |
| D. | 当反应消耗1molN2时,则消耗的H2为67.2L |
| A. | 4:10 | B. | 10:4 | C. | 4:1 | D. | 1:4 |
| 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VIA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中非金属性最强的元素是F,其单质与水反应的化学方程式为2F2+2H2O=4HF+O2;(填写元素符号)
(3)①的氢化物的化学式为NH3,其水溶液呈碱 性,
(4)表中最高价氧化物的水化物呈两性的元素的符号是Al,写出该元素的最高价氧化物的水化物与⑨的最高价氧化物对应水化物反应的化学方程式:Al(OH)3+KOH=KAlO2+2H2O;
(5)用电子式表示②③两种元素形成化合物的过程
 .
. 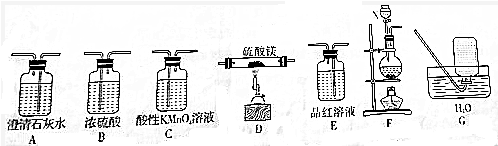
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.