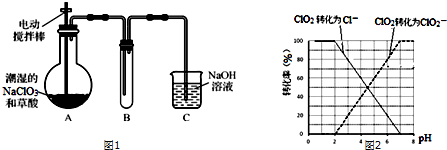
题目内容
15.下列有关化学用语正确的是( )| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | |
| B. | 氨分子的电子式: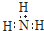 | |
| C. | 苯乙酸钠的结构简式: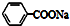 | |
| D. | H2SO3的电离方程式:H2SO3?2H++SO32- |
分析 A.硫原子质子数为16,质量为为34;
B.氨气分子的电子式中漏掉了氮原子的1对未成键电子;
C.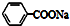 为苯甲酸钠;
为苯甲酸钠;
D.亚硫酸为二元弱酸,在溶液中部分电离出氢离子和亚硫酸氢根离子.
解答 解:A.硫原子质子数为16,质量为为34,该硫原子可以表示为:1634S,故A正确;
B.氨气分子中氮原子最外层达到8电子稳定结构,漏掉了氮原子的一对孤电子对,氨气的电子式为 ,故B错误;
,故B错误;
C.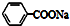 为苯甲酸钠,故C错误;
为苯甲酸钠,故C错误;
D.亚硫酸为二元弱酸,在溶液中部分电离出氢离子和亚硫酸氢根离子,其电离方程式为:H2SO3?H++HSO3-,故D错误.
故选A.
点评 本题考查了电子式、结构简式、电离方程式、离子符号等化学用语的表示方法判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,选项D为易错点,注意离子化合物中阴离子需要标出最外层电子.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
5.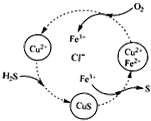 用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
 用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )| A. | 氢、氯、铜三元素的化合价未发生改变 | |
| B. | 转化过程中包含三步化学反应 | |
| C. | 转化过程中还原剂为H2S和FeCl2 | |
| D. | 总反应可表示为:2H2S+O2→2S+2H2O |
6.下列说法正确的是( )
| A. | 木糖醇( 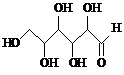 )和葡萄糖( )和葡萄糖(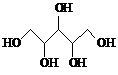 )互为同系物,均 )互为同系物,均属于糖类 | |
| B. | 分子式为C6H14的有机物其一氯代物有三种,此有机物可能是3,3-二甲基丁烷 | |
| C. | 聚乙烯(PE)和聚氯乙烯(PVC)的单体都是不饱和烃,均能使溴水褪色 | |
| D. | 等质量的乙烯、甲醚、碳酸二甲酯(CH3OCOOCH3)完全燃烧耗氧量一定不相同 |
3.下列说法正确的是( )
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 丙烯的比例模型为: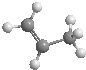 | |
| C. | 1mol物质: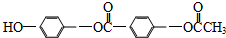 最多能与3mol NaOH反应 最多能与3mol NaOH反应 | |
| D. | CH3CN的电子式为: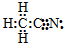 |
10.雾霾天气对环境影响很大.其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
①由表判断NaHSO3溶液显酸性,从原理的角度解释其原因在NaHSO3溶液中HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-两种平衡,HSO3-的电离程度大于其水解程度,故溶液呈酸性.
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.
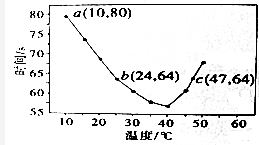
①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.

①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
20.给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
| A. | Mg$→_{点燃}^{CO_{2}}$C$→_{△}^{H_{2}SO_{4}(浓)}$SO3 | |
| B. | 0.1mol•L-1HCl$→_{△}^{MnO_{2}}$Cl2$\stackrel{石灰水}{→}$Ca(ClO)2(aq) | |
| C. | NaCl饱和溶液$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 淀粉溶液$→_{△}^{稀硫酸}$葡萄糖$→_{△}^{Cu(OH)_{2}悬浊液}$Cu2O |
4.常温下,下列推断正确的是( )
| A. | 由水电离出的c(OH-)=1×10-12mol•L-1,pH一定为2 | |
| B. | 将0.02mol•L-1的NaOH溶液.氨水分别稀释a倍、b倍后均得到pH=9的溶液,则a<b | |
| C. | 将pH=1与pH=3的两份盐酸等体积混合后,所得溶液的pH=2(忽略混合时溶液体积的变化) | |
| D. | 等体积的0.2mol•L-1盐酸与0.2mol•L-1氢氧化钡溶液混合后,所得溶液的pH=13(忽略混合时溶液体积的变化) |
14.实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr $\frac{\underline{\;\;△\;\;}}{\;}$ NaHSO4+HBr↑,CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见下表:

(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.

| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点能使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其主要目的是吸收SO2、Br2、HBr防止空气污染.
(5)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(6)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.