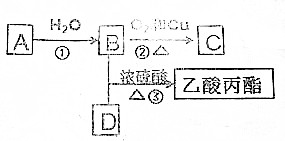
题目内容
2. 以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )
以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示.下列说法不正确的是( )| A. | b电极为负极,发生氧化反应 | |
| B. | a电极发生的反应为N2+8H++6e-=2NH4+ | |
| C. | A溶液中所含溶质为NH4Cl | |
| D. | 当反应消耗1molN2时,则消耗的H2为67.2L |
分析 以N2、H2为原料,以溶有A的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,电流从正极流向负极,以此解答该题.
解答 解:A.原电池中失电子的一极为负极,则通入氢气的b极为负极,故A正确;
B.放电过程中,负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,故B正确;
C.根据负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,则H2为负极,A为NH4Cl,故C正确;
D.负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,当反应消耗1molN2时,则消耗的H2为3mol,在标准状况下为67.2L,没有说明是标准状况,故D错误.
故选D.
点评 本题考新型燃料电池,侧重于学生的分析能力的考查,注意根据总反应式判断出正负极的反应,从化合价变化的角度分析,难度不大.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
12.将铜和氧化铁的混和物溶于足量稀盐酸,再向所得溶液滴入2滴 KSCN溶液后出现红色.下列有关说法错误的是( )
| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
13.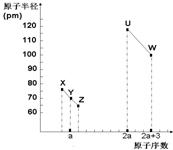 X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
 X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )| A. | U、X、W 三种元素最高价氧化物的水化物酸性依次增强 | |
| B. | 由Y、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | XZ2、YZ2与X60的化学键类型和晶体类型都相同 | |
| D. | T元素与U同主族且在下一周期,能形成化合物TW4、TZ2、T3Y4 |
10.雾霾天气对环境影响很大.其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2.
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
①由表判断NaHSO3溶液显酸性,从原理的角度解释其原因在NaHSO3溶液中HSO3-存在HSO3-?H++SO32-和HSO3-+H2O?H2SO3+OH-两种平衡,HSO3-的电离程度大于其水解程度,故溶液呈酸性.
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.

①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
(1)室温下,吸收液吸收SO2的过程中,pH随n(SO32─):n(HSO3─)变化关系如下表:
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
②在NaHSO3溶液中离子浓度关系不正确的是A(填序号).
A.c(Na+)=2c(SO32─)+c(HSO3─)
B.c(Na+)>c(HSO3─)>c(H+)>c(SO32─)>c(OH─)
C.c(H2SO3)+c(H+)=c(SO32─)+c(OH─)
D.c(Na+)+c(H+)=2c(SO32-)+c(HSO3─)+c(OH─)
③计算室温下HSO3─?H++SO32─的电离平衡常数K=6.3×10-8(保留2位有效数字).
(2)NaHSO3溶液在不同的温度下均可被过量的KIO3氧化,当NaHSO3完全消耗即有I2析出,将浓度均为0.02mol•L-1 的NaHSO3溶液(含少量淀粉)10.0mL和 KIO3(过量)酸性溶液40.0mL混合,记录溶液变蓝时间,实验结果如图.

①由图可知,溶液变蓝的时间随温度的变化趋势是40℃之前,温度越高,溶液变蓝所需时间越短;40℃之后,温度越高,溶液变蓝所需时间越长.
40℃之后,淀粉不适宜用作该实验的指示剂(填“适宜”或“不适宜”),原因是:温度高于40℃时,碘与淀粉的显色反应灵敏度降低(或淀粉会糊化).
②b点和c点对应的反应速率的大小关系是ν (b)<ν (c)(填“>”、“<”或“﹦”).
17.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为19.Y原子的电子层数与最外层电子数的比等于$\frac{1}{3}$,Z原子最外层电子数与内层电子数的比为$\frac{1}{10}$.下列说法正确的是( )
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
11.下列实验操作、现象与所得结论一致的是( )
| 实验操作 | 现象 | 结论 | |
| A | 向盛有25mL沸水的烧杯中滴加5~6滴FeCl3饱和溶液,继续煮沸 | 溶液生成红褐色沉淀 | 制得Fe(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液, | 前者溶液变蓝, 后者有黄色沉淀 | KI3溶液中存在平衡: I3-?I2+I- |
| C | 将溴乙烷和NaOH乙醇溶液混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液 褪色 | 一定产生了乙烯 |
| D | 在滴有酚酞的Na2CO3溶液中,加入CaCl2溶液 | 溶液褪色 | CaCl2溶液有酸性 |
| A. | A | B. | B | C. | C | D. | D |
1.已知:C(s)+2NO(g)?N2(g)+CO2(g). T℃时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
(1)0~10min以V(NO)表示的平均反应速率为0.042mol/(L•min).
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.