题目内容
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
分析 A.使甲基橙呈红色的溶液,显酸性;
B.离子之间发生氧化还原反应;
C.离子之间结合生成络离子;
D.C(OH-)=0.1mol•L-1的溶液,显碱性.
解答 解:A.使甲基橙呈红色的溶液,显酸性,酸性溶液中不能大量存在AlO2-、CO32-,故A错误;
B.H+、Fe2+、H2O2发生氧化还原反应,不能大量共存,故B错误;
C.Fe3+、SCN-结合生成络离子,不能大量共存,故C错误;
D.C(OH-)=0.1mol•L-1的溶液,显碱性,该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
8.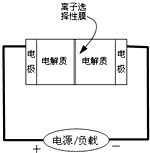 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
6.反应A(g)+3B(g)?2C(g)△H<0,达平衡后,将反应体系的温度升高,下列叙述中正确的是( )
| A. | 逆反应速率增大更大,平衡向逆反应方向移动 | |
| B. | 正反应速率增大更大,平衡向正反应方向移动 | |
| C. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 | |
| D. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 |
13.下列反应中,HCl只作还原剂的是( )
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
3.下列说法中正确的是( )
| A. | 物质发生化学反应时不一定都伴随着能量变化 | |
| B. | 伴有能量变化的变化都是化学变化 | |
| C. | 在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 | |
| D. | 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
10.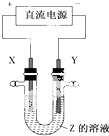 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
8.在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+bB(g)?xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图(2)中,Y轴是指( )
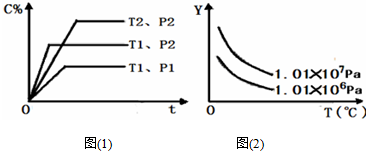

| A. | 反应物A的百分含量 | B. | 反应物B的平衡转化率 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气的总物质的量 |
 PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.