题目内容
10.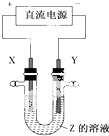 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
分析 A、外加电流的阴极保护法中,阴极是待保护金属;
B、铜的精炼中,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液;
C、电镀工业上,镀层作阳极,镀件作阴极;
D、氯碱工业上,用惰性电极电解饱和氯化钠溶液,阳极上析出氯气,阴极上析出氢气,阴极附近得到氢氧化钠.
解答 解:A、外加电流的阴极保护法中,阴极是待保护金属,即Y是待保护金属,故A正确.
B、铜的精炼中,粗铜作阳极X,纯铜作阴极Y,硫酸铜溶液作电解质溶液,故B错误;
C、电镀工业上,Y是待镀金属,X是镀层金属,故C错误;
D、氯碱工业上,用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,即Y附近能得到氢氧化钠,故D错误;
故选A.
点评 本题考查了电解原理,根据电解时离子的放电顺序、电镀、电解精炼、金属的腐蚀与防护来分析解答即可,难度不大,注意原电池原理和电解池原理是高考的热点,应掌握此知识点.

练习册系列答案
相关题目
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
5.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |
15.如图是某同学鉴别NH4HCO3、NH4Cl、KCl三种化肥的过程,其中试剂甲和乙分别可能是( )


| A. | 甲:NaOH; 乙:稀盐酸 | B. | 甲:水; 乙:氢氧化钠溶液 | ||
| C. | 甲:氢氧化钠溶液; 乙:水 | D. | 甲:稀盐酸; 乙:氯化钠溶液 |
20.将下列物质加入或通入紫色石蕊溶液中,不能使其褪色的是( )
| A. | SO2 | B. | Cl2 | C. | Na2O2 | D. | NaClO |
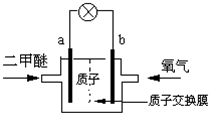 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域.

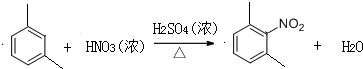 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
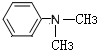 (写结构简式).
(写结构简式).