题目内容
8.在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+bB(g)?xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强).在图(2)中,Y轴是指( )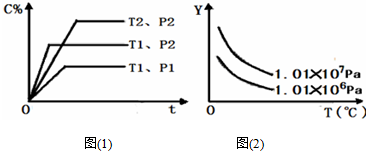
| A. | 反应物A的百分含量 | B. | 反应物B的平衡转化率 | ||
| C. | 平衡混合气的密度 | D. | 平衡混合气的总物质的量 |
分析 首先根据C的百分含量--时间变化曲线判断方程式的特征:在相同温度线,增大压强(P2>P1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x,在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,在此基础上进一步判断Y随温度、压强的变化.
解答 解:由C的百分含量--时间变化曲线可知:在相同温度线,增大压强(P2>P1),C的百分含量增大,说明增大压强平衡向正反应方向移动,则有a+b>x,
在相同压强下升高温度(T1>T2),C的百分含量降低,则说明升高温度平衡向逆反应分析移动,该反应的正反应为放热反应,则
A.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,A的百分含量减小,与图象不符,故A错误;
B.由C的百分含量--时间变化曲线可知,增大压强平衡向正反应方向移动,B的平衡转化率增大,与图象相符,故B正确;
C.由于反应容器的体积不变,气体的质量不变,则温度变化,平衡混合气的密度不变,故C错误;
D.升高温度,平衡向逆反应分析移动,则混合气体的物质的量增多,而不是减少与图象不符合,故D错误;
故选B.
点评 本题考查化学平衡的变化图象题目,题目难度不大,注意曲线的变化趋势,把握平衡移动的各物理量的变化.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
16.下列离子在指定溶液中一定能大量共存的是( )
| A. | 加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | pH=13的溶液中:Na+、CO32-、K+、HCO3- | |
| C. | 在无色溶液中:Cu2+、Ca2+、SO42-、Cl- | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、Cl-、K+、SO42- |
13.下列导电能力最差的电解质( )
| A. | 熔融的NaOH | B. | 硫磺 | C. | 石墨棒 | D. | KNO3晶体 |
20.将下列物质加入或通入紫色石蕊溶液中,不能使其褪色的是( )
| A. | SO2 | B. | Cl2 | C. | Na2O2 | D. | NaClO |
17.常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( )
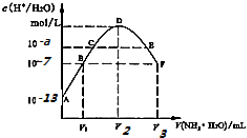

| A. | 稀硫酸的浓度为0.1mol/L | |
| B. | C点溶液pH=14-a | |
| C. | E溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| D. | B到D、D到F所加氨水体积一定相等 |
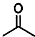 ,则键线式为
,则键线式为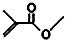 的物质的分子式为C5H8O2.
的物质的分子式为C5H8O2.