题目内容
13.下列反应中,HCl只作还原剂的是( )| A. | Zn+2HCl═ZnCl2+H2↑ | B. | O2+4HCl═2Cl2+2H2O | ||
| C. | MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O | D. | 2HCl═Cl2+H2 |
分析 氯化氢作还原剂,氯化氢中的氢元素的化合价是最高价,所以氢元素不能再失去电子,故氯化氢中的氯元素失电子化合价升高,以此解答该题.
解答 解:A.Zn+2HCl═ZnCl2+H2↑反应中,氯元素的化合价不变,氢元素的化合价降低,所以HCl是氧化剂,故A错误;
B.Cl元素化合价升高,被氧化,HCl只作还原剂,故B正确;
C.反应中,氯元素的化合价升高,氢元素的化合价不变,所以HCl是还原剂,同时表现酸性,故C错误;
D.H、Cl元素化合价发生变化,HCl既是氧化剂也是还原剂,故D错误.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
3.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸充分反应,其中( )
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
5.下列说法正确的是( )
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向氨水中加入氢氧化钠或氯化铵都能使氨水的电离平衡逆向移动,一水合氨的电离常数减小 | |
| C. | 向氯水中加入CaCO3可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1HF溶液加水稀释,其电离平衡常数和$\frac{c({H}^{+})}{c(HF)}$均不变 |


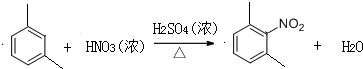 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
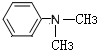 (写结构简式).
(写结构简式). ,则键线式为
,则键线式为 的物质的分子式为C5H8O2.
的物质的分子式为C5H8O2.