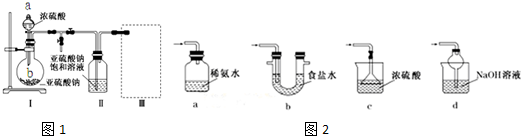
题目内容
9. PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.(1)处理NOx的一种方法是利用甲烷催化还原NOx.
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ•mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ•mol-1
CH4(g)+2NO2 (g)=N2(g)+CO2(g)+2H2O(g)△H3
则△H3=-867kJ•mol-1,如果三个反应的平衡常数依次为K1、K2、K3,则K3=K3=(K1•K2)1/2(用K1、K2表示)
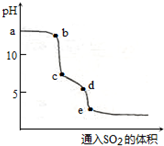
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol•L-1NaOH溶液通入
SO2过程中的pH变化曲线如图所示.ab段发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
分析 (1)对已知热化学方程式编号,依据已知的热化学方程式利用盖斯定律构造CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),然后根据关系式得到平衡常数的关系;
(2)向20mL0.1mol•L-1NaOH溶液通入SO2过程中首先发生SO2+2OH-=SO32-+H2O,其次发生SO2+SO32-+H2O=2HSO3-,据此分析.
解答 解:(1)①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律$\frac{1}{2}×$(①+②)得到CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1,
如果三个反应的平衡常数依次为K1、K2、K3,则K3=(K1•K2)1/2;
故答案为:-867kJ•mol-1;K3=(K1•K2)1/2;
(2)向20mL0.1mol•L-1NaOH溶液通入SO2过程中首先发生SO2+2OH-=SO32-+H2O,其次发生SO2+SO32-+H2O=2HSO3-;所以ab段发生反应的离子方程式为SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O.
点评 本题考查了反应热的计算和离子方程式的书写,掌握盖斯定律和无机物的化学性质是解题的关键,难度中等,注意化学平衡常数与化学方程式的数学关系.

练习册系列答案
相关题目
14.下列有关叙述中正确的是( )
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 同一弱电解质溶液,温度不同时,导电能力相同 |
18.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 使甲基橙呈红色的溶液:Na+、NH4+、AlO2-、CO32- | |
| B. | 8%H2O2溶液:H+、Fe2+、SO42-、Cl- | |
| C. | 含有Fe3+的溶液:Na+、Al3+、Cl-、SCN- | |
| D. | C(OH-)=0.1mol•L-1的溶液:Na+、K+、CO32-、ClO- |
 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域. 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验: