题目内容
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)处理NOx的一种方法是利用甲烷催化还原NOx.已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(2)利用反应6NO2+8NH3
| 催化剂 |
| 加热 |
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0.该反应的化学平衡常数表达式为K=
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4).已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,则另一反应的离子方程式为
考点:用盖斯定律进行有关反应热的计算,氧化还原反应的计算,化学平衡常数的含义,化学平衡的影响因素
专题:氧化还原反应专题,化学反应中的能量变化,化学平衡专题
分析:(1)利用盖斯定律分析,不管化学反应是一步或分几步完成,其反应热是不变的;依据热化学方程式和盖斯定律构造目标热化学方程式并计算反应热;
(2)根据化合价的变化结合方程式计算;NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子;
(3)依据平衡常数概念列式计算,△S表示反应的熵变,依据浓度商和平衡常数比较分析判断;
(4)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子,据此写出反应的离子方程式.
(2)根据化合价的变化结合方程式计算;NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子;
(3)依据平衡常数概念列式计算,△S表示反应的熵变,依据浓度商和平衡常数比较分析判断;
(4)SO2转化为SO42-该过程为氧气氧化二价铁离子到三价铁离子,然后用三价铁离子氧化二氧化硫到硫酸根离子,据此写出反应的离子方程式.
解答:
解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律计算(①+②)×
得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)反应6NO2+8NH3
7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NO20.3mol,体积为6.72L,
NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,同时二氧化氮被还原生成亚硝酸根离子,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:6.72L 2NO2+2NaOH=NaNO3+NaNO2+H2O;
(3)反应方程式2NO(g)+2CO(g)?2CO2(g)+N2(g)的化学平衡常数表达式为:K=
,
△S表示反应的熵变,该反应为气体体积减小的反应,所以△S<0,
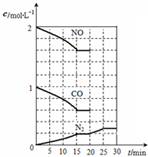
依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;平衡常数K=
=
=0.035,若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,浓度分别为c(NO)=1.6mol/L,c(CO)=0.6mol/L+0.6mol/L=1.2mol/L,c(N2)=0.2mol/L+0.6mol/L=0.8mol/L,c(CO2)=0.4mol/L;Qc=
=0.035=K,平衡不移动,
20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:
;<;不;②;
(4)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
由盖斯定律计算(①+②)×
| 1 |
| 2 |
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(2)反应6NO2+8NH3
| 催化剂 |
| 加热 |
NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,同时二氧化氮被还原生成亚硝酸根离子,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O,
故答案为:6.72L 2NO2+2NaOH=NaNO3+NaNO2+H2O;
(3)反应方程式2NO(g)+2CO(g)?2CO2(g)+N2(g)的化学平衡常数表达式为:K=
| C(N2)C2(CO2) |
| C2(NO)C2(CO) |
△S表示反应的熵变,该反应为气体体积减小的反应,所以△S<0,
依据图象分析,15分钟时达到平衡时氮气浓度为0.2mol/L,NO平衡浓度为1.6mol/L,一氧化碳浓度为0.6mol/L,二氧化碳浓度为0.4mol/L,2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0;平衡常数K=
| C(N2)C2(CO2) |
| C2(NO)C2(CO) |
| 0.2×0.42 |
| 0.62×1.62 |
| 0.8×0.42 |
| 1.62×1.22 |
20min时,若改变反应条件,导致N2浓度发生如图1所示的变化,斜率减小反应速率减小,氮气浓度增大,反应是气体体积减小的放热反应,则改变的条件可能是降温,
故答案为:
| C(N2)C2(CO2) |
| C2(NO)C2(CO) |
(4)常温下将SO2转化为SO42-而实现SO2的处理.含SO2的废气通入含Fe2+、Fe3+的溶液时其中一个反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为三价铁离子氧化二氧化硫到硫酸根离子,反应的离子方程式为:2Fe3++SO2+2H20=2Fe2++SO42-+4H+,
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评:本题考查了反应热的计算、化学反应速率与化学平衡图象的综合利用、化学平衡常数的计算、氧化还原反应方程式的书写等知识,题目难度较大,试题的计算量较大,涉及的知识点较多,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,(3)为难点,注意先计算出化学平衡常数,然后再根据浓度商判断平衡移动方向.

练习册系列答案
相关题目
密闭容器中进行如下反应:N2O4(g)?2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是( )
| A、46 | B、61.3 |
| C、76.7 | D、69 |
工业生产硫酸可表示为:FeS2→SO2→SO3→H2SO4
已知:FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g);△H═-853kJ?mol-1
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
已知:FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
| A、-130.3kJ?mol-1 |
| B、-1310.2kJ?mol-1 |
| C、-1179.kJ?mol-1 |
| D、-853kJ?mol-1 |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
| A、锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B、日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |