题目内容
密闭容器中进行如下反应:N2O4(g)?2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是( )
| A、46 | B、61.3 |
| C、76.7 | D、69 |
考点:化学平衡的计算
专题:
分析:根据N2O4转化率计算出反应前后总物质的量的变化情况,再根据混合气体平均式量=
计算.
| 气体的总质量 |
| 总物质的量 |
解答:
解:设起始N2O4的物质的量为1mol,则质量为92g,当N2O4转化率为33.3%时,则生成0.666mol的NO2,剩余N2O4为0.667mol,反应过程中气体总质量守恒,所以混合气体的平均摩尔质量为
g/mol=69.0g/mol,所以混合气体的平均式量为69.0,
故选D.
| 92 |
| 0.666+0.667 |
故选D.
点评:本题主要考查了混合气体的平均式量的计算,难度不大,解题时注意运用好基本的公式.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述正确的是( )
| A、向AgCl悬浊液中加入足量的NaI溶液,无明显现象 |
| B、CCl4和NH3两分子各原子最外层均满足8电子结构 |
| C、若短周期R2+和M+的电子层结构相同,则金属性R>M |
| D、硝酸铵溶于水吸热,是焓减熵增的过程 |
已知Ksp(AgX)=1.8×10-10,Ksp(AgY)=5.0×10-13,Ksp(AgZ)=8.3×10-17.某溶液中含有X-、Y-、Z-三种离子,其浓度均为0.01mol/L,向该溶液中逐滴加入AgNO3溶液时,最后出现沉淀的是( )
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
下列关于说法正确的是( )
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
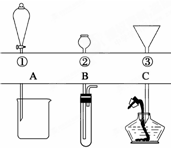 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.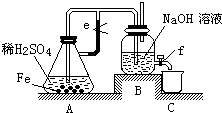
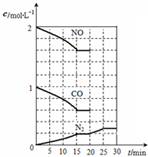 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.