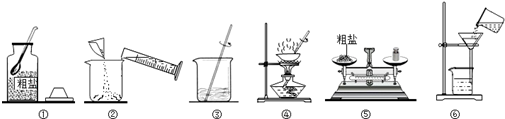
题目内容
表示溶液浓度的方法通常有两种:溶液中溶质的质量分数(ω)和物质的量浓度(c),因此在配制溶液时,根据不同的需要,有不同的配制方法.请完成下列问题.
(1)用10%(密度为1.01g?cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液.
①计算:需 g10%(密度为1.0lg?cm-3)的NaOH溶液,其体积为 mL(保留一位小数),需加 mL水进行稀释.
②量取:用 mL量筒量取10%的NaOH溶液,量取时视线要跟量筒内液体 相切,然后倒入烧杯里,用 mL量筒量取蒸馏水注入烧杯里.(可供选择的量筒规格有:5mL、10mL、25mL、50mL)
③溶解:用 (填仪器名称)将上述溶液搅拌均匀,即得27.5g2%的NaOH溶液.
(2)把98%(密度为1.84g?cm-3)的浓硫酸稀释成3mol?L-1的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸 mL(保留一位小数).
②配制操作可分解成如下几步,正确的操作顺序是 .
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线.
(1)用10%(密度为1.01g?cm-3)的NaOH溶液配制成27.5g2%的NaOH溶液.
①计算:需
②量取:用
③溶解:用
(2)把98%(密度为1.84g?cm-3)的浓硫酸稀释成3mol?L-1的稀硫酸100mL,回答下列问题:
①需要量取浓硫酸
②配制操作可分解成如下几步,正确的操作顺序是
A.向容量瓶中注入少量蒸馏水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将洗涤液注入容量瓶中,并重复操作两次
C.把已冷却的稀硫酸注入经检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶的塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使液面达到刻度线
H.继续往容量瓶中加蒸馏水,使液面接近刻度线.
考点:配制一定物质的量浓度的溶液,溶液中溶质的质量分数及相关计算
专题:
分析:(1)①依据稀释前后溶质的质量不变计算需要10%氢氧化钠溶液的质量;依据V=
计算溶液的体积,确定加入水的体积;
②依据溶液的体积和需要水的体积选择合适的量筒;
③依据稀释溶液过程中玻璃棒的作用解答;
(2)①依据C=
计算浓硫酸的物质的量浓度,依据稀释前后溶质的物质的量不变计算需要浓硫酸的体积;
②依据配制一定物质的量浓度溶液的一般步骤解答.
| m |
| ρ |
②依据溶液的体积和需要水的体积选择合适的量筒;
③依据稀释溶液过程中玻璃棒的作用解答;
(2)①依据C=
| 1000ρω |
| M |
②依据配制一定物质的量浓度溶液的一般步骤解答.
解答:
解:(1)①设需要10%氢氧化钠溶液的质量为m,依据稀释前后溶质的质量不变,m×10%=27.5g×2%,解得m=5.5g,溶液的体积V=
=5.4mL;需要水的质量为27.5g-5.5g=22g,水的密度为1g/mL,所以需要水的体积为22.0mL;
故答案为:5.5;5.4;22;
②量取5.5ml溶液应选择10ml量筒;量取22ml水应选择25ml量筒;读数时,量筒内液体凹液面最低处应与视线相切;
故答案为:10;凹液面最低处;25;
③用玻璃棒搅拌使溶液混合均匀,故答案为:玻璃棒;
(2)①浓硫酸的物质的量浓度C=
=
=18.4mol/L,依据稀释前后溶质的物质的量不变,设需要浓硫酸体积为V,则:V×18.4mol/L=3mol?L-1×100mL,解得V=16.3mL;
故答案为:16.3;
②用浓溶液配制一定物质的量浓度稀溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的顺序为:ADECBHGF;
故答案为:ADECBHGF.
| 5.5g |
| 1.0lg?cm-3 |
故答案为:5.5;5.4;22;
②量取5.5ml溶液应选择10ml量筒;量取22ml水应选择25ml量筒;读数时,量筒内液体凹液面最低处应与视线相切;
故答案为:10;凹液面最低处;25;
③用玻璃棒搅拌使溶液混合均匀,故答案为:玻璃棒;
(2)①浓硫酸的物质的量浓度C=
| 1000ρω |
| M |
| 1000×1.84g/ml×98% |
| 98g/mol |
故答案为:16.3;
②用浓溶液配制一定物质的量浓度稀溶液一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等,所以正确的顺序为:ADECBHGF;
故答案为:ADECBHGF.
点评:本题考查了配置一定质量百分数浓度和一定物质的量浓度溶液,明确配置的原理和正确的操作步骤是解题关键,侧重考查学生对基本实验原理和操作的掌握情况,题目难度不大,注意浓硫酸的稀释.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
已知Ksp(AgX)=1.8×10-10,Ksp(AgY)=5.0×10-13,Ksp(AgZ)=8.3×10-17.某溶液中含有X-、Y-、Z-三种离子,其浓度均为0.01mol/L,向该溶液中逐滴加入AgNO3溶液时,最后出现沉淀的是( )
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
下列关于说法正确的是( )
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.