题目内容
工业生产硫酸可表示为:FeS2→SO2→SO3→H2SO4
已知:FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g);△H═-853kJ?mol-1
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
已知:FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
| A、-130.3kJ?mol-1 |
| B、-1310.2kJ?mol-1 |
| C、-1179.kJ?mol-1 |
| D、-853kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:根据盖斯定律,①+②+③×2得:FeS2(s)+
O2(g)+2H2O(l)═
Fe2O3(s)+2H2SO4(l)△H=(-853kJ?mol-1)+(-196.6kJ?mol-1)+2×(-130.3kJ?mol-1)=-1310.2kJ?mol-1,由热化学方程式可知1mol FeS2完全转化为H2SO4的反应热.
| 15 |
| 4 |
| 1 |
| 2 |
解答:
解:①FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g)△H═-853kJ?mol-1
②2SO2(g)+O2(g)═2SO3(g)△H═-196.6kJ?mol-1
③SO3(g)+H2O(l)═H2SO4(l)△H═-130.3kJ?mol-1
根据盖斯定律,①+②+③×2得:FeS2(s)+
O2(g)+2H2O(l)═
Fe2O3(s)+2H2SO4(l)△H═(-853kJ?mol-1)+(-196.6kJ?mol-1)+2×(-130.3kJ?mol-1)=-1310.2kJ?mol-1,
故选B.
| 11 |
| 4 |
| 1 |
| 2 |
②2SO2(g)+O2(g)═2SO3(g)△H═-196.6kJ?mol-1
③SO3(g)+H2O(l)═H2SO4(l)△H═-130.3kJ?mol-1
根据盖斯定律,①+②+③×2得:FeS2(s)+
| 15 |
| 4 |
| 1 |
| 2 |
故选B.
点评:本题考查了盖斯定律的应用,中等难度,注意用已知方程进行适当加减得到待求方程,对应反应热也进行相应计算.

练习册系列答案
相关题目
已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6KJ/mol,下列说法正确的是( )
| A、1molSO2(g)和0.5molO2(g)置于密闭容器中 在一定条件下充分反应,放热98.3KJ |
| B、若升高温度,正反应速率增大,逆反应速率减小 |
| C、其他条件不变时,加入催化剂,速率一定加快 |
| D、2molSO2(g)和1molO2(g)具有的能量之和大于2molSO3(g)具有的能量 |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lgc(M),p(CO32-)=-lgc(CO32-).下列说法正确的是( )| A、MgCO3、CaCO3、MnCO3的Ksp依次增大 |
| B、a点可表示MnCO3的饱和溶液,且c(Mn2+)<c(CO32-) |
| C、b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-) |
有关AgCl沉淀的溶解平衡,下列说法正确的是( )
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率为0 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与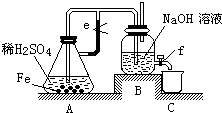
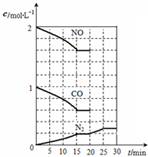 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.