题目内容
工业上“除钙、镁”的原理反应为:
MgSO4+2NaF=MgF2↓+Na2SO4;CaSO4+2NaF=CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中
= .
MgSO4+2NaF=MgF2↓+Na2SO4;CaSO4+2NaF=CaF2↓+Na2SO4
已知KSP(CaF2)=1.11×10-10,KSP(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中
| c(Ca2+) |
| c(Mg2+) |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:依据题给的信息得知CaF2和MgF2的溶度积分别是钙离子的浓度与氟离子浓度的平方和镁离子的浓度与氟离子浓度的平方,故据此转化为求两者的溶度积之比即可.
解答:
解:
=
=
=
=1.5,故答案为:1.5.
| c(Ca2+) |
| c(Mg2+) |
| c(Ca2+)?c2(F-) |
| c(Mg2+)?c2(F-) |
| Ksp(CaF2) |
| Ksp(MgF2) |
| 1.11×10-10 |
| 7.40×10-11 |
点评:本题考查难溶电解质的溶解平衡,明确溶度积常数的含义是解此题关键,属于中等题.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列关于说法正确的是( )
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
有关AgCl沉淀的溶解平衡,下列说法正确的是( )
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率为0 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强.在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是( )
| A、FeS、Al(OH)3和S |
| B、Fe(OH)3和Al(OH)3 |
| C、Fe2S3和 Al(OH)3 |
| D、Al2S3、FeS和S |
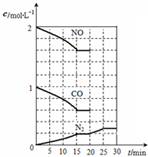 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
 以下各物质均为中学阶段常见的物质,其中B 是单质,它们的相互转化关系如图
以下各物质均为中学阶段常见的物质,其中B 是单质,它们的相互转化关系如图