题目内容
20.按要求完成以下化学方程式:(是离子反应的只写离子方程式)(1)铁在氯气中燃烧2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(2)将二氧化硫气体通入足量的澄清石灰水中SO2+Ca2++2OH-═CaSO3↓+H2O;
(3)工业上氨在催化剂作用下与氧气反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(4)钠与硫酸铜溶液反应2Na+2H2O=2Na++OH-+H2↑、Cu2++2OH-═Cu(OH)2↓.
分析 (1)铁在氯气燃烧生成氯化铁;
(2)将二氧化硫气体通入足量的澄清石灰水中反应生成亚硫酸钙沉淀和水;
(3)氨气催化氧化生成一氧化氮和水;
(4)钠与硫酸铜反应,先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠.
解答 解:(1)铁在氯气燃烧生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(2)将二氧化硫气体通入足量的澄清石灰水中反应生成亚硫酸钙沉淀和水,离子方程式:SO2+Ca2++2OH-═CaSO3↓+H2O;
故答案为:SO2+Ca2++2OH-═CaSO3↓+H2O;
(3)氨气催化氧化生成一氧化氮和水,化学方程式:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(4)钠与硫酸铜反应,先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,离子方程式:2Na+2H2O=2Na++OH-+H2↑;Cu2++2OH-═Cu(OH)2↓;
故答案为:2Na+2H2O=2Na++OH-+H2↑;Cu2++2OH-═Cu(OH)2↓.
点评 本题考查化学方程式的书写、离子方程式的书写,明确反应的先后顺序及物质的性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
10.向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是( )
| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
11.运用元素周期律分析下列推断,其中错误的是( )
| A. | 硫酸锶难溶于水 | |
| B. | 铍是一种轻金属,它的氧化物的水化物可能具有两性 | |
| C. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 | |
| D. | 砹单质是一种有色固体,砹化氢很不稳定用 |
8.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
15.在从海带中提取碘的实验中,下列做法错误的是( )
| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
12. 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )| A. | A点时pH=1 | |
| B. | 恰好完全沉淀时Ba(OH)2溶液的体积为2L | |
| C. | B点时,溶液中的离子浓度关系为c(Na+)>c(SO42-)>c(H+)=c(OH-) | |
| D. | C点时pH=14 |
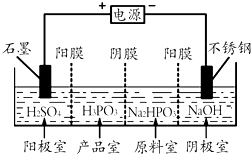 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.