题目内容
10.向等物质的量浓度的NaOH和Na2S的混合溶液中加入稀硫酸,下列离子方程式与事实不相符的是( )| A. | OH-+S2-+2H+→HS-+H2O | B. | 2OH-+S2-+4H+→H2S↑+2H2O | ||
| C. | 2OH-+S2-+3H+→HS-+2H2O | D. | OH-+S2-+3H+→H2S↑+H2O |
分析 氢氧化钠、硫化钠等物质的量混合物中加入硫酸,氢离子先与氢氧根离子反应,剩余氢离子再与硫离子反应,氢离子少量,生成硫氢根离子,氢离子过量生成硫化氢.
解答 解:A.设NaOH和Na2S物质的量都是1mol,加入1mol硫酸,发生反应:OH-+S2-+2H+→HS-+H2O,故A正确;
B.设NaOH和Na2S物质的量都是2mol,加入1.5mol硫酸根离子,发生反应:2OH-+S2-+3H+→HS-+2H2O,故B正确;
C.设NaOH和Na2S的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,剩余2mol氢离子与2molS2-反应生成2mol硫氢根离子,离子方程式应为2OH-+2S2-+4H+→2SH-+2H2O,故C错误;
D.设NaOH和Na2S物质的量都是1mol,加入1.5mol硫酸,发生反应的离子方程式:OH-+S2-+3H+→H2S↑+H2O,故D正确;
故选:C.
点评 本题考查了离子方程式的书写,题目难度中等,明确氢氧根离子、硫离子与氢离子反应的顺序和过程是解题关键,注意反应物的量对生成物的影响.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
20.用铂电极(惰性)电解下列溶液时,阴极和阳极的主要产物分别是H2和O2的是( )
| A. | 稀KOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
1.对四支试管中的无色溶液中进行以下操作,由现象判断的结论正确的是( )
| 操作 | 现象 | 结论 | |
| A | 滴加Ba(NO3)2溶液 | 生成白色沉淀 | 原溶液中只含SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
18.下列各溶液中,微粒的物质的量浓度关系不正确的是( )
| A. | 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 Na2CO3溶液:2c(Na+)=c(HCO3-)+c(CO32?)+c(H2CO3) | |
| C. | 0.1 mol•L-1 NH4Cl溶液:c(NH4+)=c( Cl-) | |
| D. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
5.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这四种金属的活动性顺序是( )
| 实验装置 | 部分实验现象 | 实验装置 | 部分实验现象 |
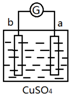 | a极质量减小, b极质量增加 | 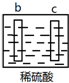 | b极有气体产生, c极无变化 |
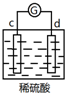 | d极溶解, c极有气体产生 | 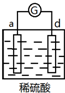 | 电流计指示在导线中电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
15.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2Ca(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
实验流程如下:

完成下列填空:
(1)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是d.
a.冷水 b.热水 c.乙醇 d.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:

步骤1:充分反应后,过滤除去CaSO4沉淀.步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2Ca(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

完成下列填空:
(1)第②步中所加CaCO3还发生了其他反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是d.
a.冷水 b.热水 c.乙醇 d.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:

步骤1:充分反应后,过滤除去CaSO4沉淀.步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
2.下列有关化学用语正确的是( )
| A. | CO2的结构式:O-C-O | B. | 羟基的电子式: | ||
| C. | NH3分子比例模型: | D. | Cl-的结构示意图: |
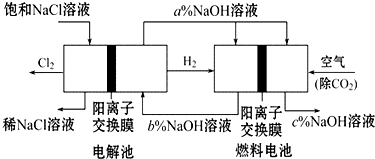 有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:
有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题: