题目内容
5.将一定量的晶体A(NH4HC2O4)隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体.这四种物质与其他的相互转化关系如图所示.F和J是中学化学中常见的两种单质.H为红棕色气体.图中部分反应条件及生成物没有列出.请按要求填空: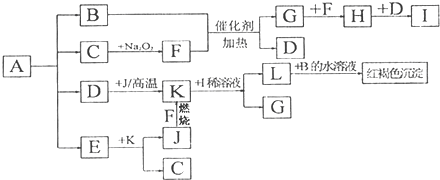
(1)E的化学式为CO
(2)写出B和F反应的化学方程式4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,L和B的水溶液反应的离子方程式Fe3++3 NH3•H2O=Fe(OH)3+3NH4+;
(3)写出K与I的稀溶液反应的离子方程式3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
(4)标准状况下,将充满H的试管倒立在水槽中并通入适量的F,充分反应后液体充满试管,不考虑溶液中物质的扩散,则试管中溶液的物质的量浓度为:$\frac{1}{22.4}$mol/L;
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G生成,该反应的化学方程式是2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑.
分析 加热A(NH4HC2O4)分解得到等物质的量的四种气体,气体B与F反应得到G与D,F是中学化学中常见的单质,则G与F反应得到H为红棕色气体,则C为CO2,F为O2,B为NH3,G为NO,D为H2O,H为NO2,I为HNO3.L与B的水溶液反应得到红褐色沉淀为Fe(OH)3,D(H2O)与单质J在高温下反应,结合转化关系,根据Fe元素守恒可知,J为Fe,K为Fe3O4,L为Fe(NO3)3,E可K与反应生成Fe和CO2,则E具有还原性,则E为CO.
解答 解:加热A(NH4HC2O4)分解得到等物质的量的四种气体,气体B与F反应得到G与D,F是中学化学中常见的单质,则G与F反应得到H为红棕色气体,则C为CO2,F为O2,B为NH3,G为NO,D为H2O,H为NO2,I为HNO3.L与B的水溶液反应得到红褐色沉淀为Fe(OH)3,D(H2O)与单质J在高温下反应,结合转化关系,根据Fe元素守恒可知,J为Fe,K为Fe3O4,L为Fe(NO3)3,E可K与反应生成Fe和CO2,则E具有还原性,则E为CO.
(1)E的化学式为CO,故答案为:CO;
(2)B和F反应的化学方程式:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,
L和B的水溶液反应的离子方程式:Fe3++3 NH3•H2O=Fe(OH)3+3NH4+,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;Fe3++3 NH3•H2O=Fe(OH)3+3NH4+;
(3)K与I的稀溶液反应的离子方程式:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(4)标准状况下,将充满NO2的试管倒立在水槽中并通入适量的O2,充分反应后液体充满试管,令NO2为1L,由N原子守恒可知生成硝酸为$\frac{1L}{22.4L/mol}$=$\frac{1}{22.4}$mol,则试管中溶液的物质的量浓度为$\frac{1}{22.4}$mol/L,
故答案为:$\frac{1}{22.4}$mol/L;
(5)工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备某高效净水剂Fe(OH)SO4,反应有G(NO)生成,该反应的化学方程式是:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑.
点评 本题考查无机物的推断,物质的状态、颜色及转化中特殊反应为推断突破口,需要学生熟练掌握元素化合物知识,侧重于学生的分析能力和元素化合物知识的综合运用,难度中等.

| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+═AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO32-+2H+═H2O+CO2↑ |
| D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
| 实验内容 | 实验现象 | 解释及结论 |
| 观察氯水的颜色、状态 | 呈黄绿色 | ① C |
| 向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② A |
| 用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ B |
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.
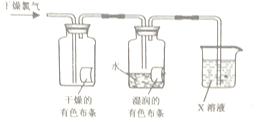
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
| A. | 镁、石墨均能导电,所以它们均是电解质 | |
| B. | NH3、SO2的水溶液均能导电,所以NH3、S02均是电解质 | |
| C. | 液态HC1、固体Na2SO4均不能导电,所以HC1、Na2S04均是非电解质 | |
| D. | 蔗糖、酒精在水溶液和熔融状态下均不能导电,所以它们均是非电解质 |
| A. | 能使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe2+ | |
| B. | 能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl- | |
| C. | 常温pH<7的溶液K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液K+、SO42-、Cl-、H+ |
| A. | 元素 | B. | 单质 | C. | 氧化物 | D. | 分子 |
| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |