题目内容
10.想下列溶液中,各组离子一定能够大量共存的是( )| A. | 能使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe2+ | |
| B. | 能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl- | |
| C. | 常温pH<7的溶液K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液K+、SO42-、Cl-、H+ |
分析 A.能使酚酞试液变红的溶液,显碱性;
B.能使紫色石蕊试液变红的溶液,显酸性,离子之间发生氧化还原反应;
C.常温pH<7的溶液,该组离子之间不反应;
D.离子之间结合生成水和气体.
解答 解:A.能使酚酞试液变红的溶液,显碱性,不能大量存在Fe2+,故A错误;
B.能使紫色石蕊试液变红的溶液,显酸性,Fe2+、MnO4-发生氧化还原反应,不能大量共存,故B错误;
C.常温pH<7的溶液,该组离子之间不反应,可大量共存,故C正确;
D.HCO3-、H+结合生成水和气体,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
1.下列物质中,不能通过单质直接化合生成的是( )
| A. | HCl | B. | MgO | C. | SO3 | D. | CO2 |
18.下列各组离子在溶液中可以大量共存的是( )
| A. | Fe2+、H+、Cl-、NO3- | B. | Na+、Ba2+、OH-、NO3- | ||
| C. | OH-、K+、NO3-、HCO3- | D. | Fe3+、NH4+、SO42-、SCN- |
2.下列物质之间的转化,需要加入适当的氧化剂才能完成的是( )
| A. | SO3→H2SO4 | B. | HNO3→NO | C. | Fe→FeCl2 | D. | Cl2→HClO |


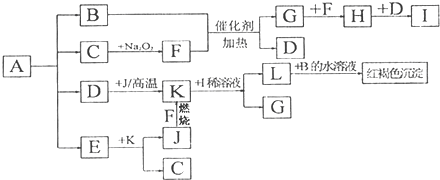
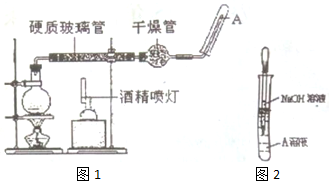
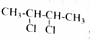 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: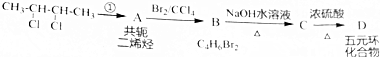
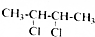 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.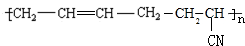 等.
等.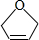 .
.