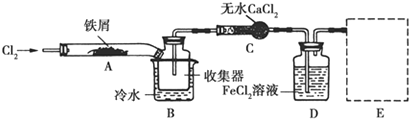
题目内容
16.2005年诺贝尔化学奖授予在“烯烃复分解反应”研究方面作出贡献的三位科学家.“烯烃复分解反应”是指在金属钼、钌等催化剂的作用下,碳碳双键断裂并重新组合的过程.如两分子烯烃RCH=CHR′用上述催化剂作用会生成两种新的烯烃RCH=CHR和R′CH=CHR′.则由CH2=CHCH2CH3和CH2=C(CH3)2发生“烯烃复分解反应”,生成新烯烃种类为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 根据题所给信息烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃解题.
解答 解:因烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃,则CH2═C(CH3)CH3与CH2═CHCH3发生烯烃复分解反应生成的烯烃有CH2═CH2、CH3C(CH3)═C(CH3)CH3、CH3C(CH3)═CHCH2CH3和CH3CH2CH═CHCH2CH3四种,故选C.
点评 本题考查有机物结构和性质,侧重考查学生获取信息利用信息解答问题能力,正确理解给予信息采用信息迁移的方法分析解答是解本题关键,题目难度不大.

练习册系列答案
相关题目
6.判断下列元素中不属于主族元素的是( )
| A. | 钡 | B. | 铅 | C. | 碘 | D. | 铁 |
4. 三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
回答下列问题:
(1)写出SiHCl3的结构式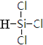 .
.
(z) SiHCl3,在NaOH溶液中剧烈反应放出H2,该反应的化学方程式为SiHCl3+5NaOH=3NaCl+Na2SiO3+H2↑+2H2O.
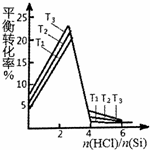
(3)硅的平衡转化率与投料比$\frac{n(HCl)}{n(Si)}$的关系如图,则图中温度T1、T2、T3的大小顺序为T1>T2>T3.
(4)平衡时,$\frac{c(SiHC{l}_{3})}{c(SiC{l}_{4})}$的值a随着$\frac{c({H}_{2})}{c(HCl)}$的值b的变化而变化.则$\frac{a}{b}$=K1/K2(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释通入H2后两个平衡均逆向移动,但对副反应影响更大,所得产物中副产物
的含量减小,所以SiHCl3的纯度提高.
(5)也可用H2还原SiCl4来制取SiHCl3.300℃时该反应的热化学方程式为H2(g)+SiCl4(g)=SiHCl3(g)+HCl(g)△H=+30kJ•mol-1.
 三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:
三氯氢硅(SiHCl3)是生产多晶硅的主要原料.由粗硅制三氯氢硅的反应如下:| 反应的热化学方程式 | 平衡常数(300℃) | |
| 主反应 | Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ•mol-1 | K1(mol•L-1)-1 |
| 副反应 | Si(s)+4HCl(g)?SiHCl4(g)+2H2(g)△H=-240kJ•mol-1 | K2(mol•L-1)-1 |
(1)写出SiHCl3的结构式
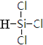 .
.(z) SiHCl3,在NaOH溶液中剧烈反应放出H2,该反应的化学方程式为SiHCl3+5NaOH=3NaCl+Na2SiO3+H2↑+2H2O.
(3)硅的平衡转化率与投料比$\frac{n(HCl)}{n(Si)}$的关系如图,则图中温度T1、T2、T3的大小顺序为T1>T2>T3.
(4)平衡时,$\frac{c(SiHC{l}_{3})}{c(SiC{l}_{4})}$的值a随着$\frac{c({H}_{2})}{c(HCl)}$的值b的变化而变化.则$\frac{a}{b}$=K1/K2(用含Kl、K2的代数式表示);根据关系式,工业上用H2适当稀释HCl来提高SiHCl3的纯度. 请用平衡移动原理加以解释通入H2后两个平衡均逆向移动,但对副反应影响更大,所得产物中副产物
的含量减小,所以SiHCl3的纯度提高.
(5)也可用H2还原SiCl4来制取SiHCl3.300℃时该反应的热化学方程式为H2(g)+SiCl4(g)=SiHCl3(g)+HCl(g)△H=+30kJ•mol-1.
11.在一定条件下,将A和B各0.32mol充入10L的恒容密闭容器中,发生如下反应:A(g)+B(g)═2C(g)△H<0.反应过程中测定的数据如下表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 其他条件不变,向平衡体系中再充入0.32molA,再达到新平衡时,B的转化率增大 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,起始时向容器中充入0.64molA和B,平衡时,n(C)<0.48mol | |
| D. | 反应前2min的平均速率ν(C)=0.004mol•(L•min)-1 |
1.下列物质中,不能通过单质直接化合生成的是( )
| A. | HCl | B. | MgO | C. | SO3 | D. | CO2 |
8.实验室保存下列物质的方法中,不正确的是( )
| A. | 少量金属钠保存在煤油里 | |
| B. | 浓硫酸存放在广口试剂瓶中 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 氯水应装在棕色细口瓶中密封避光保存 |
6.常温下,下列有关电解质溶液的说法正确的是( )
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |