题目内容
15.0.1mo1•L-1的CH3COOK溶液中,由于CH3COO-的水解,使得c(CH3C00-)<0.1mol•L-1.如果要使c(CH3C00-)更接近于0.1mo1•L-1,可以采取的措施是( )| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |
分析 CH3COO-水解的离子方程式为CH3COO-+H2O?CH3COOH+OH-,要使c(CH3C00-)更接近于0.1mo1•L-1,应使平衡向逆向移动,以此解答该题.
解答 解:CH3COO-水解呈碱性,CH3COO-水解的离子方程式为CH3COO-+H2O?CH3COOH+OH-,要使c(CH3C00-)更接近于0.1mo1•L-1,应使平衡向逆向移动,可加入KOH,而加入盐酸,生成醋酸,CH3COO-浓度降低,加入水,溶液浓度降低,加热促进水解,
故选C.
点评 本题考查学生影响盐类水解程度的主要因素知识,为高频考点,侧重于学生的分析能力的考查,注意把握影响盐类水解的因素,难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
6.常温下,下列有关电解质溶液的说法正确的是( )
| A. | pH=3的强酸溶液1mL,加水稀释至100mL后,溶液pH降低2个单位 | |
| B. | pH=2的盐酸中水电离出的H+浓度小于pH=12的氨水中水电离出的OH-浓度 | |
| C. | 0.2molCO2通入1L0.3mol•L-1KOH溶液中:2c(H+)+c(HCO3-)+3c(H2CO3)=2c(OH-)+c(CO32-) | |
| D. | 已知一定浓度的NaHSO3溶液pH=5.4,则c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) |
10.氯化铜溶液中含有少量氯化铁杂质,若要制得纯净的氯化铜,向溶液中加入下列试剂,不能达到目的是( )
| A. | NaOH | B. | CuO | C. | Cu(OH)2 | D. | Cu2(OH)2CO3 |
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,每生成1molFe3O4时,转移电子数为4NA | |
| B. | 常温常压下,2.24LCO2的质量大于4.4g | |
| C. | 常温下,1L0.1mol•L-1AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6gNa2O2和Na2S固体混合物中,含有阴离子数目大于0.2NA |
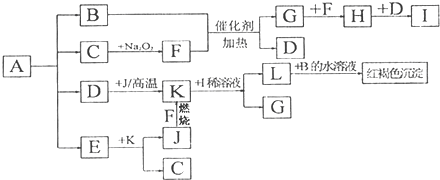
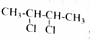 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: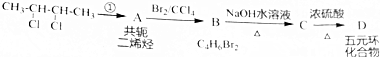
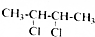 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.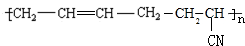 等.
等.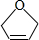 .
.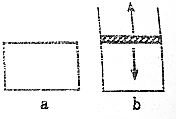 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.