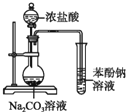
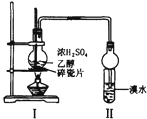
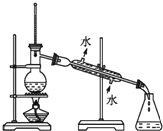
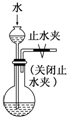
题目内容
5.34克NH3共有8mol原子,0.1molH2S共有1.204×1023个氢原子;同温同压下,等体积的NH3和H2S气体的质量比为1:2.分析 根据n=$\frac{m}{M}$计算氨气物质的量,每个氨气分子含有4个原子,则原子物质的量为氨气分子的4倍;硫化氢含有氢原子物质的量为硫化氢的2倍,同温同压下,等体积的NH3和H2S气体的物质的量相等,根据m=nM计算二者质量之比.
解答 解:34克NH3的物质的量为n=$\frac{m}{M}$=$\frac{34g}{17g/mol}$=2mol,含有原子为2mol×4=8mol原子,0.1molH2S中含有H原子数目为0.1mol×2×6.02×1023mol-1=1.204×1023,同温同压下,等体积的NH3和H2S气体的物质的量相等,根据m=nM可知,NH3和H2S的质量之比=17g/mol:34g/mol=1:2,
故答案为:8;1.204×1023;1:2.
点评 本题考查物质的量有关计算,比较基础,难度不大,注意对公式的理解与灵活应用,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
6.下列实验方法正确的是( )
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
16.有八种物质:①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
13.下列化学用语中,正确的是( )
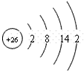
| A. | 过氧化钠的电子式: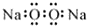 | B. | Cl-离子的结构示意图: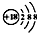 | ||
| C. | 二氧化硅的分子式:SiO2 | D. | HClO的结构式为H-O-Cl |
20.一定能在下列溶液中大量共存的离子组是( )
| A. | 水电离产生的H+浓度为1×10-12 mol•L-1的溶液:Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、CO32- | |
| C. | 含有大量Fe3+的溶液:I-、K+、Br- | |
| D. | pH=2的水溶液中:Al3+、NH4+、CH3COO- |
14.化学与生产、生活、社会密切相关.下列说法不正确的是( )
| A. | 工厂中常用的静电除尘装置是根据胶体粒子的带电性而设计的 | |
| B. | 过氧化钠(Na2O2)常用于呼吸面具或潜水艇中作为氧气的来源 | |
| C. | 波尔多液(CuSO4)常用来配制农药,主要因为Cu2+具有氧化性 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化,主要是因为胶体的吸附性 |
 .
.
 .
.