题目内容
20.一定能在下列溶液中大量共存的离子组是( )| A. | 水电离产生的H+浓度为1×10-12 mol•L-1的溶液:Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、CO32- | |
| C. | 含有大量Fe3+的溶液:I-、K+、Br- | |
| D. | pH=2的水溶液中:Al3+、NH4+、CH3COO- |
分析 A.水电离产生的H+浓度为1×10-12 mol•L-1的溶液中存在大量氢离子或氢氧根离子,碳酸氢根离子与氢离子、氢氧根离子反应;
B.能使pH试纸变深蓝色的溶液中存在大量氢氧根离子,三种离子之间不反应,都不与氢氧根离子反应;
C.铁离子能够氧化碘离子;
D.pH=2的溶液中存在大量氢离子,醋酸根离子与氢离子反应.
解答 解:A.水电离产生的H+浓度为1×10-12 mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故A错误;
B.能使pH试纸变深蓝色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Na+、AlO2-、CO32-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.pH=2的水溶液为酸性溶液,溶液中存在大量氢离子,CH3COO-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
11.1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2$→_{①}^{O_{2}/Ag}$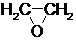 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
(1)通过反应①用乙烯和空气混合气体制备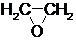 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.
计算此时乙烯的转化率.
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
CH2=CH2$→_{①}^{O_{2}/Ag}$
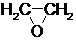 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH(1)通过反应①用乙烯和空气混合气体制备
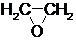 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.| C2H4 | O2 | N2 |  | |
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
8.下列关于苯、甲苯和苯酚的性质的讨论,不正确的是( )
| A. | 甲苯30°C时即可发生硝化反应,比苯的硝化容易,是由于甲基对苯环的影响 | |
| B. | 苯不能被酸性高锰酸钾溶液氧化而甲苯可以,是由于甲基对苯环的影响 | |
| C. | 苯酚可以与浓溴水发生取代反应,比苯的溴代容易,是由于羟基对苯环的影响 | |
| D. | 由于苯环和取代基的相互影响导致二者的性质均有变化 |
15.某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方.过一会,发现纸蝴蝶变为红色.下表的组合中,能够实现上述变化的是( )
| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 石蕊 | 石蕊 | 酚酞 | 石蕊 |
| 小烧杯中的溶液 | 浓盐酸 | 浓氨水 | NaOH溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
9.下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2═CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.
①BF3 ②CH2═CH2 ③
 ④CH≡CH ⑤NH3 ⑥CH4.
④CH≡CH ⑤NH3 ⑥CH4.| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
10.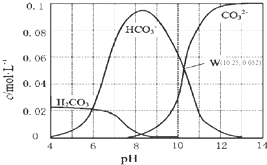 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
 25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )
25℃时,0.1mol•L-1碳酸钠溶液中通入HCl气体,含碳粒子的浓度与pH的关系如图所示.下列说法正确的是( )| A. | 在pH=7.0时,溶液中含碳粒子只有CO32-和HCO3- | |
| B. | 0.1 mol•L-1Na2CO3溶液pH=13 | |
| C. | H2CO3的Ka2=1.0×10-10.25 | |
| D. | 向100 mL 0.1 mol•L-1碳酸钠溶液中滴加盐酸至溶液pH=4.0,生成标准状况下CO2气体224 mL |
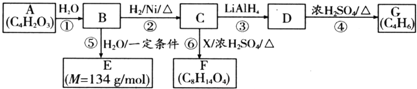
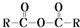 $\stackrel{H_{2}O}{→}$2RCOOH
$\stackrel{H_{2}O}{→}$2RCOOH 、
、 .
. .
.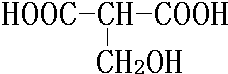 、
、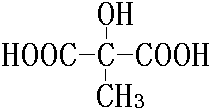 .
.