题目内容
16.有八种物质:①甲烷 ②苯 ③聚乙烯 ④1,3-丁二烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色,则有机物中含碳碳三键、碳碳双键、含酚-OH、-CHO等,以此来解答.
解答 解:①甲烷与高锰酸钾、溴水均不反应;
②苯与溴水、高锰酸钾均不反应;
③聚乙烯中不含碳碳双键,与高锰酸钾、溴水均不反应;
④1,3-丁二烯含碳碳双键,与溴水发生加成反应,与高锰酸钾发生氧化反应;
⑤2-丁炔含碳碳三键,与溴水发生加成反应,与高锰酸钾发生氧化反应;
⑥环己烷与溴水、高锰酸钾均不反应;
⑦邻二甲苯与溴水不反应;
⑧环己烯中含碳碳双键,与溴水发生加成反应,与高锰酸钾发生氧化反应,
故选C.
点评 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力和应用能力的考查,把握官能团与性质的关系为解答该题的关键,题目难度不大.

练习册系列答案
相关题目
4.现拟在实验室里利用空气和镁粉为原料,制取少量纯净的氮化镁(Mg3N2).已知实验中加热条件下可能发生的以下反应:
可供选择的装置和药品如图所示(镁粉和还原铁粉均已干燥,装置内所发生的反应都是完全的,整套装置的末端与干燥管相连接),请回答下列问题: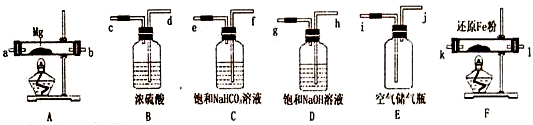
(1)为了实现实验目的,在设汁实验方案时,除装置A、E、F外,还应选择的装置有B、D(填字母代号);选择装置F的目的是为了除去空气中的氧气.
(2)连接并检査装置的气密性.实验开始时,打开自来水的开关,将空气从储气瓶压入反应装置,则气流流经导管的顺序是j→h→g→d→c→k→l(或l→k)→a→b(或b→a)(填字母代号).
(3)通入气体后,如果同时点燃A、F装置的酒精灯,对实验结果中所得产品的质量比理论值大 (填“大“或“小”),其一原因是同时点燃酒精灯,A中硬质玻璃管中的空气没有排净,其中的氧气、少量二氧化碳和水蒸气与镁反应,生成了氧化镁.另一原因是由于镁全部本该生成氮化镁,装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气与装置A中的镁粉反应,使部分镁生成了氧化镁.
(4)请设计一个实验,验证产物是氮化镁:取适量产物放入试卷中,滴加蒸馏水,将湿润的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
| 反应物 | 生成物 | 反应物 | 生成物 |
| 镁和氧气 | 氧化镁 | 镁和水 | 氧化镁和氢气 |
| 镁和氮气 | 氮化镁 | 氮化镁和水 | 氢氧化镁和氨气 |
| 镁和二氧化碳 | 氧化镁和碳 |

(1)为了实现实验目的,在设汁实验方案时,除装置A、E、F外,还应选择的装置有B、D(填字母代号);选择装置F的目的是为了除去空气中的氧气.
(2)连接并检査装置的气密性.实验开始时,打开自来水的开关,将空气从储气瓶压入反应装置,则气流流经导管的顺序是j→h→g→d→c→k→l(或l→k)→a→b(或b→a)(填字母代号).
(3)通入气体后,如果同时点燃A、F装置的酒精灯,对实验结果中所得产品的质量比理论值大 (填“大“或“小”),其一原因是同时点燃酒精灯,A中硬质玻璃管中的空气没有排净,其中的氧气、少量二氧化碳和水蒸气与镁反应,生成了氧化镁.另一原因是由于镁全部本该生成氮化镁,装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧气与装置A中的镁粉反应,使部分镁生成了氧化镁.
(4)请设计一个实验,验证产物是氮化镁:取适量产物放入试卷中,滴加蒸馏水,将湿润的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成.
11.1,3-丙二醇是重要的化工原料,用乙烯合成1,3-丙二醇的路线如下:
CH2=CH2$→_{①}^{O_{2}/Ag}$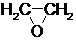 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
(1)通过反应①用乙烯和空气混合气体制备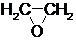 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.
计算此时乙烯的转化率.
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
CH2=CH2$→_{①}^{O_{2}/Ag}$
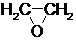 $→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH
$→_{②}^{(CO,H_{2})/Co}$ HOCH2CH2CHO$→_{③}^{H_{2}/Ni}$ HOCH2CH2CH2OH(1)通过反应①用乙烯和空气混合气体制备
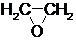 ,测得反应前和某一时刻气体的体积分数如下表.
,测得反应前和某一时刻气体的体积分数如下表.| C2H4 | O2 | N2 |  | |
| 反应前体积分数 | 25.0% | 15.0% | 60.0% | 0 |
| 某一时刻体积分数 | 5.56% | 5.54% | 66.7% | 22.2% |
(2)某化工厂已购得乙烯14t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:
C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2 CH4+H2O$\frac{\underline{\;高温\;}}{\;}$CO+3H2
假设在生产过程中,反应②中CO和H2、反应③中H2均过量20%,且反应①、②、③中各有机物的转化率均为100%.计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
1.下列事故处理措施正确的是( )
| A. | 金属钠着火,立即用水灭火 | |
| B. | 在气体发生装置上直接点燃甲烷气体时,必须先检验甲烷的纯度 | |
| C. | 酒精灯不慎着火,应立即吹熄 | |
| D. | 眼睛里溅进盐酸,立即用 NaOH 溶液洗涤眼睛 |
8.下列关于苯、甲苯和苯酚的性质的讨论,不正确的是( )
| A. | 甲苯30°C时即可发生硝化反应,比苯的硝化容易,是由于甲基对苯环的影响 | |
| B. | 苯不能被酸性高锰酸钾溶液氧化而甲苯可以,是由于甲基对苯环的影响 | |
| C. | 苯酚可以与浓溴水发生取代反应,比苯的溴代容易,是由于羟基对苯环的影响 | |
| D. | 由于苯环和取代基的相互影响导致二者的性质均有变化 |
6.将铁、铝的混合物加入到足量氢氧化钠溶液中,充分反应后过滤,再将过滤得到的固体加入到足量的硫酸铜溶液中,充分反应后过滤得到的固体质量正好与原固体质量相等,则原固体中铝的质量分数为( )
| A. | 14.3% | B. | 12.5% | C. | 87.5% | D. | 85.7% |
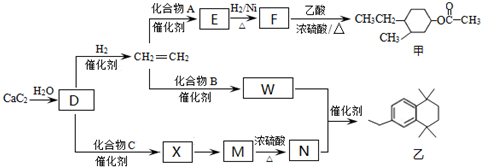
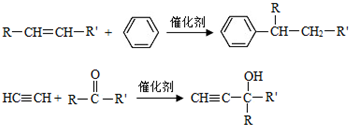 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)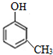 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应.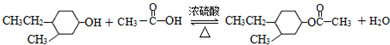 .
.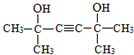 .
.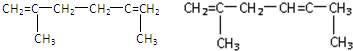 .
.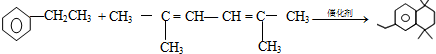 .
.