题目内容
12.下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、CO32-、SO42-、Cl- | ||
| C. | NO3-、Na+、HCO3-、Ba2+ | D. | Na+、NO3-、H+、SO42- |
分析 溶液无色,则有颜色的离子不能大量共存,溶液呈酸性,含有大量的H+,如离子之间不发生反应,且与H+不反应,则离子可大量共存,以此解答.
解答 解:A.MnO4-有颜色,不符合题目无色要求,故A错误;
B.酸性条件下,CO32-不能大量共存,CO32-与H+反应生成二氧化碳气体和水,故B错误;
C.酸性条件下HCO3-不能大量共存,HCO3-与H+反应生成二氧化碳气体和水,故C错误;
D.溶液无色,且离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力、审题能力和元素化合物知识的综合运用的考查,注意把握常见离子的性质以及反应类型的判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )
| A. | 加入AgNO3后,再加稀硝酸酸化,有白色沉淀产生,说明有Cl- | |
| B. | 新制氯水使红玫瑰变为白玫瑰,说明有Cl2 | |
| C. | 将KHCO3固体加入新制的氯水中,有气泡产生,说明有HClO | |
| D. | 光照新制氯水有气泡逸出,该气体一定是Cl2 |
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3分子数为0.1 NA | |
| B. | 标准状况下,2.24 L的CCl4中含有的C-Cl键数为0.4 NA | |
| C. | 常温常压下,3.0 g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| D. | 常温常压下,Na2O2与足量CO2反应生成2.24 L O2,转移电子数为0.2 NA |
7.某原电池装置如图所示.下列有关叙述中,正确的是( )
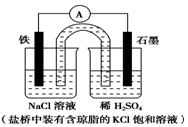

| A. | 电池工作中,盐桥的中Cl-向负极移动 | |
| B. | 负极反应:2H++2e-═H2↑ | |
| C. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| D. | Fe作正极,发生氧化反应 |
17.已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾.推测BaO2的名称为( )
| A. | 氧化钡 | B. | 过氧化钡 | C. | 超氧化钡 | D. | 无法确定 |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L N2和H2混合气体中含N个原子 | |
| B. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| C. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1N | |
| D. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2N |
1.鉴别苯酚溶液、已烯和甲苯,可选用的最佳试剂( )
| A. | 溴水 | B. | FeCl3溶液 | C. | 新制Cu(OH)2悬浊液 | D. | 酸性KMnO4溶液 |
2.Fe(OH)3可用来制颜料、药物,作净水剂.现设计实验研究制备Fe(OH)3的方法.
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-?Fe(OH)3?H++FeO2-+H2O
(1)向3支盛有1mL 1.0mol•L-1 FeCl3溶液的试管中,分别加入3mL不同浓度的NaOH溶液,都产生红褐色沉淀.充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如表:
①产生红褐色沉淀的离子方程式是Fe3++3OH-?Fe(OH)3↓.
②当c(NaOH)≥6.0 mol•L-1时,实验Ⅱ中溶液变红的原因是FeO2-+4H+?Fe3++2H2O、Fe3++3SCN-?Fe(SCN)3(用离子方程式表示).
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3.
①向1mL 1.0mol•L-1 FeCl3溶液中滴加1.0mol•L-1Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生.有同学提出沉淀中可能含有碳酸盐.将沉淀过滤、洗涤后取样,加入少量稀盐酸,有无色气体产生,证明沉淀中含有碳酸盐.
②向1mL 1.0mol•L-1FeCl3溶液中滴加1.0mol•L-1Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀.经检验沉淀中除Fe(OH)3外还含有FeSO3.产生FeSO3的原因是2Fe3++SO32-+H2O?2Fe2++SO42-+2H+、Fe2++SO32-?FeSO3↓.
(3)比较(1)和(2),制备Fe(OH)3的合理方法是1mL1.0mol•L-1FeCl3溶液与3mL浓度小于6.0mol•L-1的NaOH溶液(注明试剂和用量).
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是NaClO(写出一种即可).
资料:新制Fe(OH)3在溶液中存在两种电离:Fe3++3OH-?Fe(OH)3?H++FeO2-+H2O
(1)向3支盛有1mL 1.0mol•L-1 FeCl3溶液的试管中,分别加入3mL不同浓度的NaOH溶液,都产生红褐色沉淀.充分反应后,过滤,取滤液分成两等份,分别进行实验,实验记录如表:
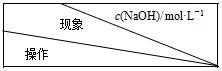 | 5.0 | 6.0 | 7.0 |
| 实验Ⅰ:滴入几滴KSCN溶液 | 不变红 | 不变红 | 不变红 |
| 实验Ⅱ:先加入过量稀硫酸,再滴入几滴KSCN溶液 | 不变红 | 变红 | 变红 |
②当c(NaOH)≥6.0 mol•L-1时,实验Ⅱ中溶液变红的原因是FeO2-+4H+?Fe3++2H2O、Fe3++3SCN-?Fe(SCN)3(用离子方程式表示).
(2)有同学提出可用某些盐与FeCl3反应制备Fe(OH)3.
①向1mL 1.0mol•L-1 FeCl3溶液中滴加1.0mol•L-1Na2CO3溶液,立即有大量气泡并有红褐色沉淀产生.有同学提出沉淀中可能含有碳酸盐.将沉淀过滤、洗涤后取样,加入少量稀盐酸,有无色气体产生,证明沉淀中含有碳酸盐.
②向1mL 1.0mol•L-1FeCl3溶液中滴加1.0mol•L-1Na2SO3溶液,溶液由黄色变为红色,无丁达尔效应,继续滴加Na2SO3溶液,最终得到红褐色沉淀.经检验沉淀中除Fe(OH)3外还含有FeSO3.产生FeSO3的原因是2Fe3++SO32-+H2O?2Fe2++SO42-+2H+、Fe2++SO32-?FeSO3↓.
(3)比较(1)和(2),制备Fe(OH)3的合理方法是1mL1.0mol•L-1FeCl3溶液与3mL浓度小于6.0mol•L-1的NaOH溶液(注明试剂和用量).
(4)FeSO4溶液仅与一种试剂反应也可制Fe(OH)3,该试剂的化学式是NaClO(写出一种即可).