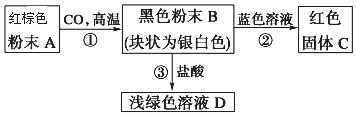
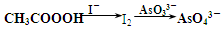题目内容
7.某原电池装置如图所示.下列有关叙述中,正确的是( )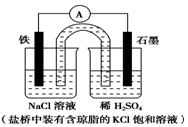
| A. | 电池工作中,盐桥的中Cl-向负极移动 | |
| B. | 负极反应:2H++2e-═H2↑ | |
| C. | 工作一段时间后,两烧杯中溶液pH均不变 | |
| D. | Fe作正极,发生氧化反应 |
分析 铁为负极,被氧化,电极反应为Fe-2e-=Fe2+,石墨为正极,发生还原反应,电极反应为2H++2e-=H2↑,结合电极反应解答.
解答 解:A.电池工作中,盐桥的中Cl-向负极移动,故A正确;
B.负极反应为Fe-2e-=Fe2+,故B错误;
C.右烧杯发生2H++2e-=H2↑,氢离子浓度减小,则pH增大,故C错误;
D.铁为负极,发生氧化反应被氧化,电极反应为Fe-2e-=Fe2+,故D错误.
故选A.
点评 本题考查原电池知识,侧重于原电池的工作原理的考查,为高考高频考点,注意把握电极反应的判断,把握电极方程式的书写,为解答该类题目的关键,难度不大.

练习册系列答案
相关题目
18.9月15日22时04分09秒,长征二号FT2火箭托举着天宫二号空间实验室腾空而起,成功送上太空.该火箭所用的推进剂偏二甲肼(分子式为C2H8N2)的摩尔质量是( )
| A. | 50g | B. | 60mol/g | C. | 60g/mol | D. | 50g/mol |
15.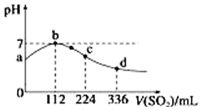 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
 标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )
标准状况下,向100mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示.下列分析正确的是( )| A. | b点水的电离程度比c点水的电离程度大 | |
| B. | 氢硫酸的酸性比亚硫酸的酸性强 | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | a点对应溶液的导电性比d点强 |
2.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.2mol/LCaCl2溶液中含Cl-数为0.4NA | |
| B. | 标准状况下,1.12L H2S气体分子中含0.5NA个质子 | |
| C. | 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | 标准状况下,4.48L的水中含有H2O分子的数目为0.2NA |
12.下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、CO32-、SO42-、Cl- | ||
| C. | NO3-、Na+、HCO3-、Ba2+ | D. | Na+、NO3-、H+、SO42- |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液:K+、Ba2+、NO3-、Cl- | |
| B. | 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | 中性溶液:Fe3+、K+、Cl-、SO42- |
16.下列离子方程式书写正确的是( )
| A. | Cu(OH)2中加入硫酸:OH-+H+=H2O | |
| B. | 钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 铁片与氯化铜溶液反应:Fe+Cu2+=Cu+Fe2+ | |
| D. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=H2O+BaSO4↓ |
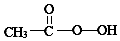 )常用作纺织品漂白剂.
)常用作纺织品漂白剂.