题目内容
17.已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾.推测BaO2的名称为( )| A. | 氧化钡 | B. | 过氧化钡 | C. | 超氧化钡 | D. | 无法确定 |
分析 K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,其中氧元素的化合价分别是-2,-1,-0.5,Ba的化合价是+2价,结合物质中O元素的化合价来确定名称.
解答 解:K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,其中氧元素的化合价分别是-2,-1,-0.5,Ba的化合价是+2价,物质中O元素的化合价是-1,所以BaO2的名称为过氧化钡,故选B.
点评 本题主要考查学生对已知信息理解能力,题目设计既包含对元素化合价的了解,又考查了学生对物质名称的读法,考查全面,注重基础,题目难度较易.

练习册系列答案
相关题目
4.在元素Fe单质及其化合物变化中,下列说法正确的是( )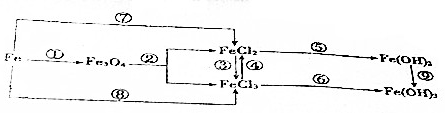

| A. | ③反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 钢铁腐蚀时,负极发生的反应是Fe-3e-═Fe3+ | |
| C. | 以Fe为电极,电解饱和NaCl溶液,阳极反应式为2Cl--2e-═Cl2↑ | |
| D. | FeCl2溶液中混有少量FeCl3,可以加入Fe、Cu等金属除去FeCl3 |
8.下列各组离子在溶液中能大量共存,且加入铝粉一定能放出氢气的是( )
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、SO42- | D. | Na+、Mg2+、NO3-、OH- |
5.下列反应中,属于氧化还原反应的是( )
| A. | CaO+2HCl=CaCl2+H2O | B. | CaO+H2O=Ca(OH)2 | ||
| C. | CaCO3=CaO+CO2↑ | D. | 2 H2O2=2H2O+O2↑ |
12.下列各组离子中,在酸性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、CO32-、SO42-、Cl- | ||
| C. | NO3-、Na+、HCO3-、Ba2+ | D. | Na+、NO3-、H+、SO42- |
2.一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1 | |
| B. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| C. | 容器Ⅰ中CO的物质的量比容器Ⅱ中的多 | |
| D. | 容器Ⅰ、Ⅱ中正反应速率相同 |
9.两种金属粉末的混合物12g,投入足量的稀硫酸中,在标准状况下产生11.2L气体,则这种混合物可能是( )
| A. | Zn、Al | B. | Fe、Zn | C. | Al、Mg | D. | Mg、Cu |
6.镁-次氯酸盐燃料电池的工作原理如图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-,下列有关说法正确的是( )

| A. | 电池工作时,c溶液中的溶质一定是MgCl2 | |
| B. | 负极反应式:ClO--2e-+H2O=Cl-+2OH- | |
| C. | 电池工作时,OH-向b电极移动 | |
| D. | b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl- |