题目内容
7.水的电离平衡曲线如图所示,下列说法中正确的是( )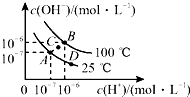
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 若处在B点,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显中性 | |
| C. | 25℃时,保持温度不变,在水中加入适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42- |
分析 A.水的电离是吸热反应,温度越高水的电离程度越大,则水的离子积常数越大;根据图知,A、D两点温度相等而低于B点温度;
B.B点时,pH=2的硫酸中c(H+)=0.01mol/L,pH=10的KOH溶液中c(OH-)=$\frac{1{0}^{-6}×1{0}^{-6}}{1{0}^{-10}}$mol/L=0.01mol/L,二者等体积混合时,酸碱恰好完全反应;
C.根据图知,C点c(H+)=c(OH-),溶液呈中性,且离子积常数大于A;
D.A对应的点中c(H+)=c(OH-),溶液呈中性,Fe3+在中性条件下不能大量存在.
解答 解:A.水的电离是吸热反应,温度越高水的电离程度越大,则水的离子积常数越大;根据图知,A、D两点温度相等而低于B点温度,所以A、B、D三点处Kw的大小关系:B>A=D,故A错误;
B.B点时,pH=2的硫酸中c(H+)=0.01mol/L,pH=10的KOH溶液中c(OH-)=$\frac{1{0}^{-6}×1{0}^{-6}}{1{0}^{-10}}$mol/L=0.01mol/L,二者等体积混合时,酸碱恰好完全反应生成强酸强碱盐,溶液呈中性,故B正确;
C.温度不变,Kw不变,向水中加入氯化铵固体,溶液中c(OH-)变大,c(H+)变大,溶液显示酸性,氢离子浓度大于氢氧根浓度,故C错误;
D.A对应的点中c(H+)=c(OH-),溶液呈中性,A点对应的溶液中大量存在Na+、Cl-、SO42-,但Fe3+、水解显酸性,不符合溶液中性,所以Fe3+在中性条件下不能大量存在,故D错误;
故选B.
点评 本题考查了水的电离、离子积的概念应用和影响条件,注意离子积常数是随温度变化的,不能根据氢离子浓度确定溶液酸碱性,易错选项是D.

练习册系列答案
相关题目
17.下列各原子或离子的电子排布式错误的是( )
| A. | Mg2+ 1s22s22p6 | B. | Br 1s22s22p63s23p63d104s24p5 | ||
| C. | O2- 1s22s22p6 | D. | Cr ls22s22p63s23p63d44s2 |
15.某学生为了探究锌与盐酸反应过程中速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下( )
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
| A. | 在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是4 一5 min,因为在此段时间内反应放出的热量较多 | |
| B. | 在2一3min时间段内,用盐酸的浓度变化表示的反应速率为0.lmol/(L•min) | |
| C. | 在该稀盐酸中分别加入等体积的蒸馏水、Na2SO4溶液或Na2CO3溶液都能减缓反应速率且不减少产生氢气的量 | |
| D. | 为了加快该化学反应速率,可以向其中加入NaCl固体 |
2.为了提纯下表所列物质(括号内为杂质),有关除杂试剂和分离方法的选择均正确的是( )
| 编号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | 苯(苯酚) | NaHCO3溶液 | 分液 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
19.一定温度下,下列说法正确的是( )
| A. | 1 mol/LNaHCO3溶液与1 mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH=x的氨水溶液,稀释10倍后,其pH=y,则x=y+1 | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中显酸性 | |
| D. | pH相同的①CH3COONa;②NaHCO3;③NaC1O三种溶液的c(Na+):①>②>③ |
17.下列说法正确的是( )
| A. | 含离子键的化合物是离子化合物,含共价键的化合物是共价化合物 | |
| B. | 离子键的形成过程中一定有电子得失 | |
| C. | 第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键 | |
| D. | 离子键与共价键的本质都是静电作用 |
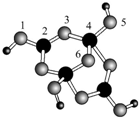 硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字).
硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示,则在Xm-中,硼原子轨道的杂化类型有sp2和sp3;配位键存在于4,5或(5,4)原子之间(填原子的数字标号);m=2(填数字). .
. ,A2C2的结构式:H-O-O-H.
,A2C2的结构式:H-O-O-H. .
.