题目内容
8.按要求填空(1)①氕、氘、氚 ②金刚石、石墨 ③35Cl、37Cl ④H2O、H2D
①互为同位素的是①④(填序号,下同)
②互为同素异形体的是③
(2)18O的中子数为10,它与H元素形成的化合物的电子式为
 .
.
分析 有相同质子数、不同中子数的原子或同一元素的不同核素互为同位素;
相同元素组成、不同形态的单质互为同素异形体.
中子数=质量数-质子数,水为共价化合物,分子中存在2个氧氢键,氧原子最外层为8电子.
解答 解:(1)①氕、氘、氚 质子数相同,中子数不同,互为同位素;④35Cl、37Cl质子数相同,中子数不同,互为同位素,故答案为:①④;
②石墨、金刚石是由碳元素形成的不同单质,互为同素异形体,故答案为:③;
(2)中子数=质量数-质子数=18-8=10,H2O中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,
,
故答案为:10; .
.
点评 本题考查同位素、同素异形体的概念以及质子数、中子数、核外电子数及其相互联系,难度不大,对于元素、核素、同位素、同素异形体、同分异构体、同种物质等概念的区别是考试的热点问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列说法正确的是( )
| A. | 含离子键的化合物是离子化合物,含共价键的化合物是共价化合物 | |
| B. | 离子键的形成过程中一定有电子得失 | |
| C. | 第ⅠA、ⅡA族元素与第ⅥA、ⅦA族元素一定形成离子键 | |
| D. | 离子键与共价键的本质都是静电作用 |
16.稀氨水中存在平衡:NH3•H2O?NH4++OH_,若要使平衡逆向移动,同时使C (OH_)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体.
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥MgSO4固体.
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
13.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | NCl3 | D. | BF3 |
18.已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法不正确的是( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
| A. | ⑦的简单离子不是同周期元素离子半径最小的 | |
| B. | 气态氢化物的稳定性①>② | |
| C. | 气态氢化物的沸点高低②>④ | |
| D. | 阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |

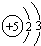 ;
; .
.