题目内容
“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题.
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
C+ KMnO4+ H2SO4→ CO2↑+ MnSO4+ K2SO4+ H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下两组数据:
①实验2条件下平衡常数K= .
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正 v逆(填“<”,“>”,“=”).
③由两组实验结果,可判断该反应的正反应△H 0(填“<”,‘‘>”,“=”).
(3)己知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
2CO(g)═2C(s)+O2(g)
①已知该反应的△H>0,简述该设想能否实现的依据: .
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 .
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为 mol/L.
(l)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②实验3,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v正
③由两组实验结果,可判断该反应的正反应△H
(3)己知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
③H2O(g)═H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
2CO(g)═2C(s)+O2(g)
①已知该反应的△H>0,简述该设想能否实现的依据:
②目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
考点:氧化还原反应方程式的配平,用盖斯定律进行有关反应热的计算,化学平衡建立的过程,化学平衡常数的含义,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(l)根据氧化还原反应中得失电子数相等和原子守恒来配平化学方程式;
(2)①依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
②计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(4)①根据G=△H-T?△S判断反应能否自发进行;
②根据生成物为氮气和二氧化碳书写;
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
(2)①依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
②计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(4)①根据G=△H-T?△S判断反应能否自发进行;
②根据生成物为氮气和二氧化碳书写;
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答:
解:(1)高锰酸钾中锰元素化合价降低7-2=5价,碳元素化合价升高4-0=4价,化合价升高数=化合价降低数,所以高锰酸钾前的系数是4,碳单质前的系数是5,根据原子守恒,二氧化碳前是5,硫酸锰前是4,硫酸钾前面是2,根据硫酸跟守恒,所以硫酸前面是6,据氧原子和氢原子守恒,6个水分子前面是6,
故答案为:5;4;6;5;4;2;6;
(2)①实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=
=
=
≈0.17,
故答案为:0.17;
②由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=
=1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
故答案为:<;
③实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,△H<0,
故答案为:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)①2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,根据G=△H-T?△S,G>0,任何温度下不能自发进行,
故答案为:根据G=△H-T?△S,G>0,不能实现;
②汽车尾气系统中装置反应的化学方程式为2CO+2NO
2CO2+N2,
故答案为:2NO+2CO
N2+CO2 ;
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=
×1×10-4mol/L=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,c(Ca2+)=
mol/L=5.6×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×5.6×10-5mol/L=1.12×10-4mol/L,
故答案为:1.12×10-4mo1/L.
故答案为:5;4;6;5;4;2;6;
(2)①实验2条件下平衡常数,需要列式计算平衡浓度;
H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 0.5mol/L 1mol/L 0 0
转化浓度 0.2mol/L 0.2mol/l 0.2mol/l 0.2mol/l
平衡浓度 0.3mol/L 0.8mol/L 0.2mol/l 0.2mol/l
K=
| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.2×0.2 |
| 0.3×0.8 |
| 1 |
| 6 |
故答案为:0.17;
②由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=
| 1×1 |
| 1×1 |
故答案为:<;
③实验1中CO的转化率为
| 1.6mol |
| 4mol |
| 0.4mol |
| 2mol |
故答案为:<;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)①2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应,根据G=△H-T?△S,G>0,任何温度下不能自发进行,
故答案为:根据G=△H-T?△S,G>0,不能实现;
②汽车尾气系统中装置反应的化学方程式为2CO+2NO
| ||
故答案为:2NO+2CO
| ||
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 5×10-5 |
故答案为:1.12×10-4mo1/L.
点评:本题考查了氧化还原反应,平衡常数计算应用,盖斯定律的计算应用自由能的应用等,同时考查学生对知识点掌握及综合运用能力,易错点是(5)题,题目难度中等,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
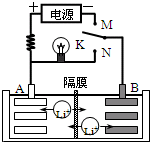 如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:负极:LixC6-xe-═C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-═LiMnO2(LiMnO2表示含锂原子的MnO2)
下列有关说法正确的是( )
A、该电池的反应式为Li1-xMnO2+LixC6
| |||
| B、K与M相接时,A是阳极,发生氧化反应 | |||
| C、K与N相接时,Li+由A极区迁移到B极区 | |||
| D、在整个充电或放电过程中都只存在一种形式的能量转化 |
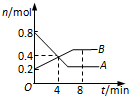 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )| A、该反应的化学方程式为:2A→B |
| B、反应开始至4 min时,A的平均反应速率为0.05 mol/(L?min) |
| C、4 min时,正、逆反应速率的大小关系为:v(正)>v(逆) |
| D、8 min时,正、逆反应速率的大小关系为:v(正)<v(逆) |
下列叙述不正确的是( )
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
下列说法正确的是( )
| A、向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降 |
| B、若NaHC2O4溶液的pH=5,则溶液中c(C2O42-)<c(H2C2O4) |
| C、pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n |
| D、室温下,pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106:1 |
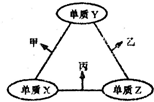 x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如图所示转化关系;其中乙和丙均为l0电子气体分子,且二者相遇生成弱碱.下列说法正确的是( )| A、X元素位于第ⅣA族 |
| B、热稳定性:乙<丙 |
| C、甲和丙可能发生氧化还原反应 |
| D、分子乙中各原子均达8电子稳定结构 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z最外层电子数相同,Z的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是( )
| A、原子半径的大小顺序:rX>rY>rW>rQ |
| B、X、Y的最高价氧化物的水化物之间不能发生反应 |
| C、元素Q和Z能形成QZ2型的共价化合物 |
| D、Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
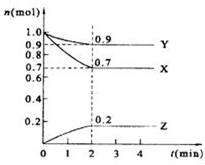 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.