题目内容
下列叙述不正确的是( )
| A、通过1H核磁共振谱图可以区分乙醇和乙酸乙酯 |
| B、常温常压下,5.6g乙烯与丁烯的混合物中含有共用电子对数目为1.2NA(设NA为阿伏加德罗常数的值.) |
| C、在50g质量分数为56%的乙醇水溶液中,含有氢原子总数为3NA(设NA为阿伏加德罗常数的值.) |
| D、煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 |
考点:有机物的鉴别,阿伏加德罗常数,煤的干馏和综合利用
专题:有机化学基础
分析:A.乙醇(CH3CH2OH)含3种H,乙酸乙酯(CH3COOCH2CH3)含3种H,但氢谱图位置不同;
B.乙烯与丁烯的最简式为CH2,烯烃分子中每个C和H各自形成1个共用电子对,根据烯烃的最简式计算出含有碳和氢原子的物质的量;
C.n(CH3CH2OH)=
mol,n(H2O)=
mol,结合分子构成及N=nNA分析;
D.煤干馏是将煤加热到900~1100℃时,可以得到焦炭、煤焦油、煤气等物质.
B.乙烯与丁烯的最简式为CH2,烯烃分子中每个C和H各自形成1个共用电子对,根据烯烃的最简式计算出含有碳和氢原子的物质的量;
C.n(CH3CH2OH)=
| 50g×56% |
| 46 |
| 50×44% |
| 18 |
D.煤干馏是将煤加热到900~1100℃时,可以得到焦炭、煤焦油、煤气等物质.
解答:
解:A.乙醇(CH3CH2OH)含3种H,乙酸乙酯(CH3COOCH2CH3)含3种H,但氢谱图位置不同,则通过1H核磁共振谱图可以区分乙醇和乙酸乙酯,故A正确;
B.乙烯和丙烯的最简式为CH2,5.6g烯烃含有
=0.4mol最简式CH2,烯烃分子中每个C和H各自形成1个共用电子对,则0.4mol最简式CH2形成0.4mol×3=1.2mol共用电子对,即乙烯和丁烯的混合气体中含有的共用电子对数为1.2NA,故B正确;
C.n(CH3CH2OH)=
mol,n(H2O)=
mol,结合分子构成可知,n(H)>3mol,则含有氢原子总数大于3NA,故C错误;
D.煤干馏为化学变化,煤加热到900~1100℃时,主要得到焦炭、煤焦油、粗氨水和焦炉气,故D正确;
故选C.
B.乙烯和丙烯的最简式为CH2,5.6g烯烃含有
| 5.6g |
| 14g/mol |
C.n(CH3CH2OH)=
| 50g×56% |
| 46 |
| 50×44% |
| 18 |
D.煤干馏为化学变化,煤加热到900~1100℃时,主要得到焦炭、煤焦油、粗氨水和焦炉气,故D正确;
故选C.
点评:本题考查较综合,涉及有机物的鉴别、物质的量的有关计算及干馏产品等,注重高考高频考点的考查,选项C为解答的易错点,注意乙醇和水中均含H原子,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,Z和Y组成原电池时,Z为电池的负极.X、Y、Z三种金属的活动性顺序为( )
| A、X>Y>Z |
| B、X>Z>Y |
| C、Y>X>Z |
| D、Y>Z>X |
列关于①苯、②乙醇、③乙酸、④葡萄糖等有机物的叙述中,不正确的是( )
| A、可以用新制氢氧化铜鉴别③与④ |
| B、只有③能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、一定条件下,④可以转化为② |
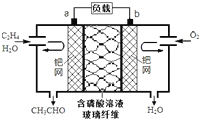 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO.下列有关说法正确的是( )| A、该电池为可充电电池 |
| B、电子移动方向:电极a→磷酸溶液→电极b |
| C、正极反应式为:CH2=CH2-2e-+2OH-→CH3CHO+H2O |
| D、每有0.1mol O2反应,则迁移H+0.4mol |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是( )
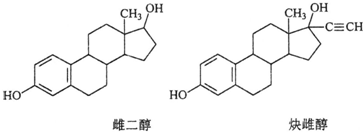

| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |
下列说法正确的是( )
| A、分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| B、能自发进行的化学反应,一定是△H<0、△S>0 |
| C、将碳酸钠溶液和碳酸氢钠溶液分别蒸干并灼烧,所得固体的成分均为氢氧化钠 |
| D、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
下列叙述不正确的是( )
| A、常温下,SO2、NO2、Cl2均为有刺激性气味、有毒的气体 |
| B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3?10H2O |
| C、人工合成的硅橡胶是目前最好的、既耐高温又耐低温的橡胶 |
| D、合金的硬度可以大于它的纯金属成分,合金的熔点也可以低于它的成分金属 |