题目内容
10.能正确表示下列化学反应的离子方程式的是( )| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
分析 A.反应生成氯化铜和水;
B.氢氧化钙完全电离;
C.电子、电荷不守恒;
D.反应生成氯化钙、水、二氧化碳,电荷不守恒.
解答 解:A.氢氧化铜与盐酸的反应的离子反应为Cu(OH)2+2H+=Cu2++2H2O,故A正确;
B.澄清的石灰水与稀盐酸反应的离子反应为OH-+H+=H2O,故B错误;
C.铜片插入硝酸银溶液中的离子反应为 Cu+2Ag+=Cu2++2Ag,故C错误;
D.碳酸钙溶于盐酸中的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍;Y的气态氢化物可以使湿润的红色石蕊试纸变蓝;液态Z可作为核反应堆的热传导剂;W与X原子最外层电子数之比为3:2.下列说法正确的是( )
| A. | 化合物Z2O2含有离子键和极性共价键 | |
| B. | 原子半径大小:W>Z>X>Y | |
| C. | WO2能使品红溶液褪色,其漂白原理与氯水类似 | |
| D. | Y的气态氢化物与其最高价氧化物的水化物可反应生成盐 |
5.氢气还原氧化亚铁:FeO+H2$\frac{\underline{\;\;△\;\;}}{\;}$ H2O+Fe,在该反应中( )
| A. | Fe做还原剂 | B. | FeO做氧化剂 | ||
| C. | 铁元素的化合价降低 | D. | 铁元素化合剂升高 |
15.下列各组物质中,前者是单质,后者是氧化物的是( )
| A. | 水 碱石灰 | B. | 金刚石 干冰 | C. | 液氧 氯酸钾 | D. | 汞 纯碱 |
2. 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,
(1)如图所示的物质分类方法名称是树状分类法.
(2)
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中①②③⑥⑧⑨⑩后面的横线上.
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,(1)如图所示的物质分类方法名称是树状分类法.
(2)
| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
 硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
硫在空气中燃烧可以生成SO2,SO2在催化剂作用下可以被氧化为SO3,其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=-297kJ/mol,SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
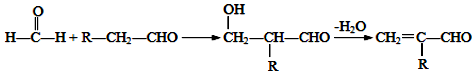
 .
.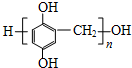 (写出一种即可).
(写出一种即可).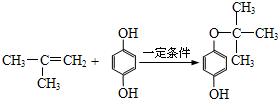 .
.