题目内容
18.有以下物质a.氨水 b.蔗糖 c.烧碱 d.NH3H2O e.CO2 f.碳酸钙 g.CH3COOH h.铜 i.氯气 j.石墨 k.稀盐酸 l.HCl气体 m.大理石 n.熔融的氯化钠
其中属于电解质的是cdfgln;属于强电解质的是cfln;属于非电解质的是be.
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;
非电解质:在水溶液中和熔融状态下都不能导电的化合物;例:有机物,非金属氧化物等;
强电解质:在水溶液中能完全电离的电解质;
弱电解质:在水溶液中部分电离的电解质;
单质与混合物既不是电解质也不是非电解质.
解答 解:a.氨水是混合物,既不是电解质也不是非电解质;
b.蔗糖 在水溶液中和熔融状态下都不能导电的化合物,是非电解质;
c.烧碱在水溶液中或熔融状态下能完全电离而产生自由移动离子而导电的化合物,是电解质,且是强电解质;
d.NH3•H2O 在水溶液中部分电离而导电,属于电解质,且是弱电解质;
e.CO2本身不能电离产生自由移动的离子的化合物,属于非电解质;
f.碳酸钙熔融状态下能够完全电离而导电的化合物,属于电解质,且是强电解质;
g.CH3COOH在水溶液中部分电离而导电,属于电解质,且是弱电解质;
h.铜是单质,既不是电解质也不是非电解质;
i.氯气 既不是电解质也不是非电解质;
j.石墨既不是电解质也不是非电解质;
k.稀盐酸,既不是电解质也不是非电解质;
l.HCl气体在水溶液中能够完全电离而导电的化合物,属于电解质,且是强电解质;
m.大理石熔融状态下能够完全电离而导电的化合物,属于电解质,且是强电解质;
n.熔融的氯化钠能够完全电离而导电的化合物,属于电解质,且是强电解质;
所以:其中属于电解质的是cdfgln;属于强电解质的是cfln;属于非电解质的是be;
故答案为:cdfgln; cfln; be.
点评 本题考查了电解质、非电解质、强电解质、弱电解质的判断,明确相关概念是解题关键,注意单质与混合物既不是电解质也不是非电解质.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
6.现有V L K2SO4和Al2(SO4)3的混合溶液,已知其中c(Al3+)为0.4mol/L,c (K+)为0.2mol/L,则溶液中SO42-的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.4 mol/L | C. | 0.8mol/L | D. | 0.7mol/L |
3.煤在燃烧时会产生SO2,造成环境污染.下列说法不正确的有( )
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 | |
| D. | 往燃煤中混入生石灰,可减少SO2排放 |
10.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
7.汽车尾气和燃煤造成空气污染.
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
写出该反应平衡常数表达式:K=$\frac{c(C{H}_{3}OC{H}_{3}){c}^{2}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$.
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
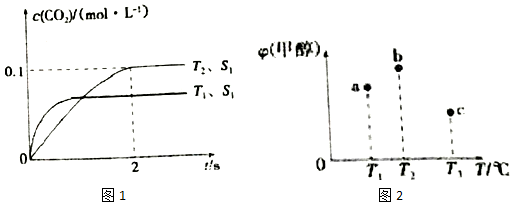
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
达到平衡时CO的转化率为45%.

(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
8.实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )
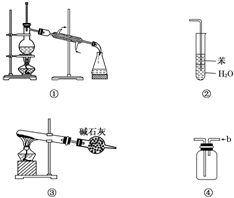

| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于制备少量CO2 | |
| D. | 装置④a口进气可收集Cl2、NO2等气体 |