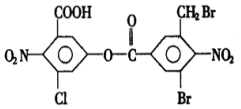
题目内容
2. 无机化合物可根据其组成和性质进行分类,
无机化合物可根据其组成和性质进行分类,(1)如图所示的物质分类方法名称是树状分类法.
(2)
| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧-- | ⑨-- ⑩-- |
(3)写出少量的⑦通入NaOH溶液的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(4)实验室制备⑦常用Na2SO3和浓H2SO4反应,检验该气体的方法是气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫
(5)写出④与⑤反应的离子方程式Ba2++CO32-=BaCO3↓.
分析 (1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树;
(2)酸电离出的阳离子全部是氢离子的化合物;碱电离出的阴离子全部为氢氧根离子;盐电离出得阳离子为金属离子,阴离子为酸根离子,和酸反应生成盐和水的氧化物为碱性氧化物,和碱反应生成盐和水的氧化物为酸性氧化物;
(3)少量的⑦位SO2通入NaOH溶液发生反应生成亚硫酸钠和水;
(4)实验室是利用亚硫酸钠和浓硫酸反应生成,检验二氧化硫气体的试剂为品红溶液;
(5)④与⑤反应是Ba(OH)2 和Na2CO3 反应生成碳酸钡和氢氧化钠.
解答 解:(1)树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,图示方法就是树状图,
故答案为:树状分类法;
(2)酸电离出的阳离子全部是氢离子的化合物,如含氧酸为H2SO4、H2SO3、HNO3、H2CO3,无氧酸为:H2S,碱电离出的阴离子全部为氢氧根离子,如NaOH、KOH、NH3.H2O;盐电离出得阳离子为金属离子,阴离子为酸根离子,如Na2SO3、NaNO3、K2SO4、K2CO3、KNO3,酸性氧化物和碱反应生成盐和水的氧化物,如SO2、SO3、CO2、N2O5.碱性氧化物是和酸反应生成盐和水的氧化物,如Na2O、K2O,
故答案为:
| 物质类别 | 酸 | 碱 | 盐 | 酸性 氧化物 | 碱性 氧化物 |
| 化学式 | ①H2SO4、H2SO3、HNO3、H2CO3 ②H2S | ③NaOH、KOH、NH3.H2O | ⑥Na2SO3、NaNO3、K2SO4、K2CO3、KNO3 | ⑦SO2 ⑧SO3、CO2、N2O5 | ⑨Na2O ⑩K2O |
故答案为:SO2+2NaOH=Na2SO3+H2O;
(4)实验室制备⑦常用亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+CO2↑+H2O,检验该气体的方法是:二氧化硫气体具有漂白性,气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫,
故答案为:Na2SO3;浓H2SO4;气体通过品红溶液褪色,加热恢复红色,证明为二氧化硫;
(5)④与⑤反应是Ba(OH)2 和Na2CO3 反应生成碳酸钡和氢氧化钠,反应的离子方程式为:Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查物质的分类、离子方程式的书写等知识,题目难度不大,注意把握相关概念是关键.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
12.己知反应2FeCl3+Cu=CuCl2+2FeCl2,则下列判断正确的是( )
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Cu>Fe2+ | D. | 氧化性:CuCl2>FeCl3 |
10.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
17.下列反应通过一步反应不能实现的是( )
| A. | CuO→Cu(OH)2 | B. | CaCO3→CaCl2 | C. | Na2SO4→NaCl | D. | Mg(NO3)2→KNO3 |
7.汽车尾气和燃煤造成空气污染.
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
写出该反应平衡常数表达式:K=$\frac{c(C{H}_{3}OC{H}_{3}){c}^{2}({H}_{2}O)}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$.
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
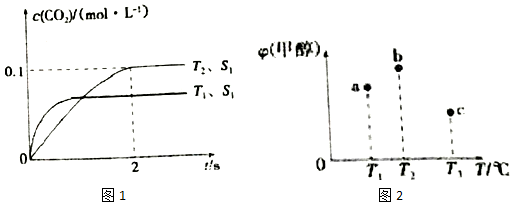
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
达到平衡时CO的转化率为45%.

(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |