题目内容
19.软质隐形眼镜材料W、树脂X的合成路线如图所示.
已知:
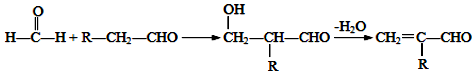
(1)A中含有的官能团的结构简式是碳碳双键、醛基.
(2)甲的结构简式是CH3CH2CHO.
(3)B→C反应的化学方程式是
 .
.(4)B有多种同分异构体.属于酯且含有碳碳双键的同分异构体共有3种(不考虑顺反异构.
(5)已知F的相对分子质量为110,1molF可与足量钠反应生成22.4L氢气(标准状况下),
苯环上的氢原子化学环境都相同.则F还能发生的反应是ab(填序号)
a.加成反应 b.氧化反应 c.加聚反应 d.水解反应
(6)写出树脂X可能的结构简式
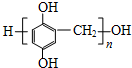 (写出一种即可).
(写出一种即可).(7)E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,生成E的化学方程式是
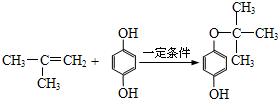 .
.
分析 由合成路线可知,利用逆推法结合W可知,C为CH2=C(CH3)COOCH2CH2OH,B与乙二醇发生酯化反应生成C,则B为CH2=C(CH3)COOH,A→B发生氧化反应,则A为CH2=C(CH3)CHO,A→D发生加成反应,D为CH3CH(CH3)CH2OH,结合已知信息可知,甲为醛,与HCHO反应再脱水生成A,则甲为CH3CH2CHO,F的相对分子质量为110,1molF可与足量钠反应生成22.4L氢气,则F分子中有两个羟基,苯环上的氢原子化学环境都相同,则F为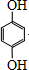 ,E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,则2-甲基丙烯与F发生加成反应生成E,E为
,E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,则2-甲基丙烯与F发生加成反应生成E,E为 ,然后结合有机物的结构与性质来解答.
,然后结合有机物的结构与性质来解答.
解答 解:由合成路线可知,利用逆推法结合W可知,C为CH2=C(CH3)COOCH2CH2OH,B与乙二醇发生酯化反应生成C,则B为CH2=C(CH3)COOH,A→B发生氧化反应,则A为CH2=C(CH3)CHO,A→D发生加成反应,D为CH3CH(CH3)CH2OH,结合已知信息可知,甲为醛,与HCHO反应再脱水生成A,则甲为CH3CH2CHO,F的相对分子质量为110,1molF可与足量钠反应生成22.4L氢气,则F分子中有两个羟基,苯环上的氢原子化学环境都相同,则F为 ,E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,则2-甲基丙烯与F发生加成反应生成E,E为
,E的分子式为C10H14O2,含三个甲基,苯环上的一溴代物有两种,则2-甲基丙烯与F发生加成反应生成E,E为 ,
,
(1)A为CH2=C(CH3)CHO,含碳碳双键、醛基两种官能团,故答案为:碳碳双键、醛基;
(2)由上述分析可知,甲为CH3CH2CHO,故答案为:CH3CH2CHO;
(3)B→C反应的化学方程式是 ,
,
故答案为: ;
;
(4)B为CH2=C(CH3)COOH,属于酯且含有碳碳双键的同分异构体有HCOOCH=CHCH3、HCOOC(CH3)=CH2、CH3COOCH=CH2,共3种,
故答案为:3;
(5)F为 ,能发生苯环的加成反应及酚-OH的氧化反应,故答案为:ab;
,能发生苯环的加成反应及酚-OH的氧化反应,故答案为:ab;
(6)F与HCHO发生缩聚反应生成X,则树脂X可能的结构简式为 ,故答案为:
,故答案为: ;
;
(7)生成E的化学方程式是 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的合成,为高考常见的题型,注意利用合成流程图中物质的结构中碳链变化、官能团变化等采用逆推法分析各物质是解答本题的关键,侧重反应类型及物质结构与性质的考查,题目难度中等.

| A. | 氢氧化铜与盐酸的反应 Cu(OH)2+2H+=Cu2++2 H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag | |
| D. | 碳酸钙溶于盐酸中 CaCO3+H+=Ca2++H2O+CO2↑ |
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如表:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)<V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是BCE.
A.容器中密度不变
B.容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2):v(H2)=1:3
E.单位时间内消耗2mol CO2,同时消耗1mol二甲醚
F.△H不变
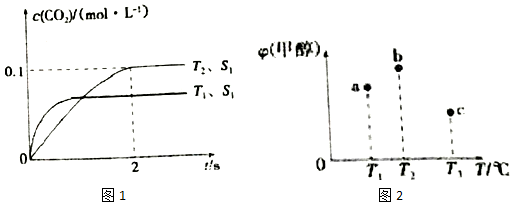
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)?2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.
①在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s);
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线.
(3)工业上用CO和H2合成 CH3OH:CO (g)+2H2(g)?CH3OH (g)
①现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图2所示.下列说法正确的是c
a.正反应的△H>0
b.反应进行到5min时,b容器中v正=v逆
c.减压可使甲醇的含量由b点变成c点
d.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
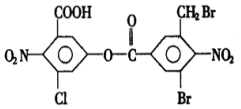
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
已知:RCH2COONa+NaOH(CaO)$\stackrel{△}{→}$RCH3+Na2CO3.
| A. | 5mol,10mol | B. | 6mol,2mol | C. | 8mol,4mol | D. | 8mol,2mol |
| A. | 混合气体通过盛有水的洗气瓶 | |
| B. | 通过装有过量浓溴水的洗气瓶 | |
| C. | 先将混合气体通过酸性高锰酸钾溶液中,然后再通入NaOH溶液中 | |
| D. | 混合气与过量氢气混合 |
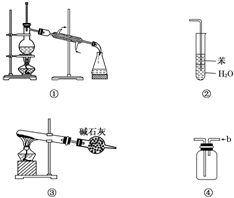
| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收氨气,能够防止倒吸 | |
| C. | 以NH4HCO3为原料,装置③可用于制备少量CO2 | |
| D. | 装置④a口进气可收集Cl2、NO2等气体 |
(1)写出F原子的外围电子排布式3d64s2.
| 元 素 | M | F | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(3)F和M(质子数为25)两元素的部分电离能数据列于右表:比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是:Mn2+的3d轨道电子排布为半满状态较稳定.
(4)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(5)如图a、b分别为M、F晶体的堆积模型,假设M的原子半径分别为Ranm,它的空间利用率:(不用化简)M$\frac{π}{3\sqrt{2}}$.
