题目内容
某课外活动小组设计了如图所示的实验装置进行实验. 回答下列 问题:
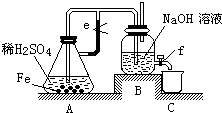
(1)开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为: ,B中可以观察到的现象是 .
(2)数分钟后夹上弹簧夹e,B中可以观察到的现象是 .
(3)如果开启活塞f放掉
液体,B中可观察到的现象是 ,有关反应的化学方程式是 .

(1)开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:
(2)数分钟后夹上弹簧夹e,B中可以观察到的现象是
(3)如果开启活塞f放掉
| 2 |
| 3 |
考点:实验装置综合
专题:实验题
分析:(1)铁和稀硫酸之间反应生成硫酸亚铁和氢气,产生气体会沿着e处导管进入B中;
(2)A中气压增加,会将生成的硫酸亚铁以及剩余的硫酸压入B中和氢氧化钠混合反应;
(3)氢氧化亚铁不稳定,容易被氧气氧化为氢氧化铁.
(2)A中气压增加,会将生成的硫酸亚铁以及剩余的硫酸压入B中和氢氧化钠混合反应;
(3)氢氧化亚铁不稳定,容易被氧气氧化为氢氧化铁.
解答:
解:(1)铁和稀硫酸之间反应生成硫酸亚铁和氢气,Fe+2H+=Fe2++H2↑,夹子e是打开的,产生气体会沿着e处导管进入B中,故答案为:Fe+2H+=Fe2++H2↑;导管口有气泡冒出;
(2)数分钟后夹上弹簧夹e,A中气压增加,会将生成的硫酸亚铁以及剩余的硫酸压入B中和氢氧化钠混合反应:OH-+H+=H2O,Fe2++2OH-=Fe(OH)2,立即产生白色沉淀,
故答案为:A中溶液进入B中,立即产生白色沉淀;
(3)如果开启活塞f放掉
液体,会有空气进入B中,氢氧化亚铁不稳定,容易被空气中的氧气氧化为氢氧化铁,4Fe(OH)2+O2+2H2O=4Fe(OH)3,看到沉淀逐渐变为灰绿色,最后变为红褐色,
故答案为:沉淀逐渐变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)数分钟后夹上弹簧夹e,A中气压增加,会将生成的硫酸亚铁以及剩余的硫酸压入B中和氢氧化钠混合反应:OH-+H+=H2O,Fe2++2OH-=Fe(OH)2,立即产生白色沉淀,
故答案为:A中溶液进入B中,立即产生白色沉淀;
(3)如果开启活塞f放掉
| 2 |
| 3 |
故答案为:沉淀逐渐变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查了氢氧化亚铁的制备,氢氧化亚铁不稳定,易被空气氧化生成氢氧化铁而变质,为制取氢氧化亚铁,需要将空气隔绝,只要不存在氧气就能制得较纯净的氢氧化亚铁,题目难度不大.

练习册系列答案
相关题目
密闭容器中进行如下反应:N2O4(g)?2NO2(g),当测得N2O4转化率为33.3%时,混合气体平均式量是( )
| A、46 | B、61.3 |
| C、76.7 | D、69 |
已知25℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
| A、温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| B、AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| D、将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
工业生产硫酸可表示为:FeS2→SO2→SO3→H2SO4
已知:FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g);△H═-853kJ?mol-1
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
已知:FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
| A、-130.3kJ?mol-1 |
| B、-1310.2kJ?mol-1 |
| C、-1179.kJ?mol-1 |
| D、-853kJ?mol-1 |